多篇顶刊论文证实:脆弱拟杆菌可增强肿瘤免疫治疗效果并降低副作用
国外学者对于脆弱拟杆菌的机制和机理研究是比较充分的,尤其是临床上最热门的肿瘤领域,自2005年开始,不断有高分文章在顶刊上发表,通过动物实验证实和阐明其强劲的双向免疫调节机制。在机制与机理上,中国研究者虽然目前相对落后,但由于中国科学家原创研发的BF839,迄今为止仍是全世界唯一合法上市的脆弱拟杆菌,所以中国的医师和用户,在脆弱拟杆菌干预肿瘤的临床研究和应用方面,仍拥有无可比拟的先天优势。
2015年Science的一篇文章发现:免疫检查点抑制剂(CTLA-4抗体)的抗肿瘤作用依赖于肠道菌群。抗生素负荷或无菌小鼠中的肿瘤对CTLA抗体治疗没有反应,通过脆弱拟杆菌(B. fragilis, BF)灌胃则可以部分恢复CTLA抗体的抗癌效果,并可减轻由CTLA-4阻断诱导的结肠炎的组织病理学征象。该研究揭示了BF菌增强了CTLA-4抗体的疗效,并降低副作用[5]
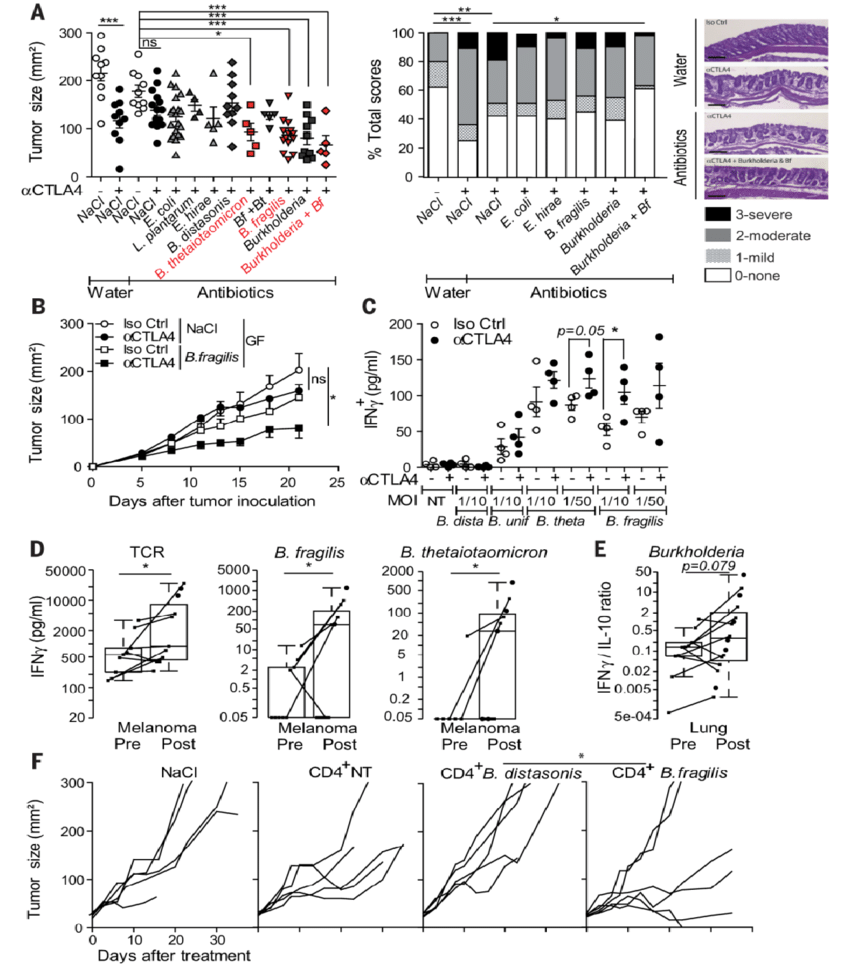
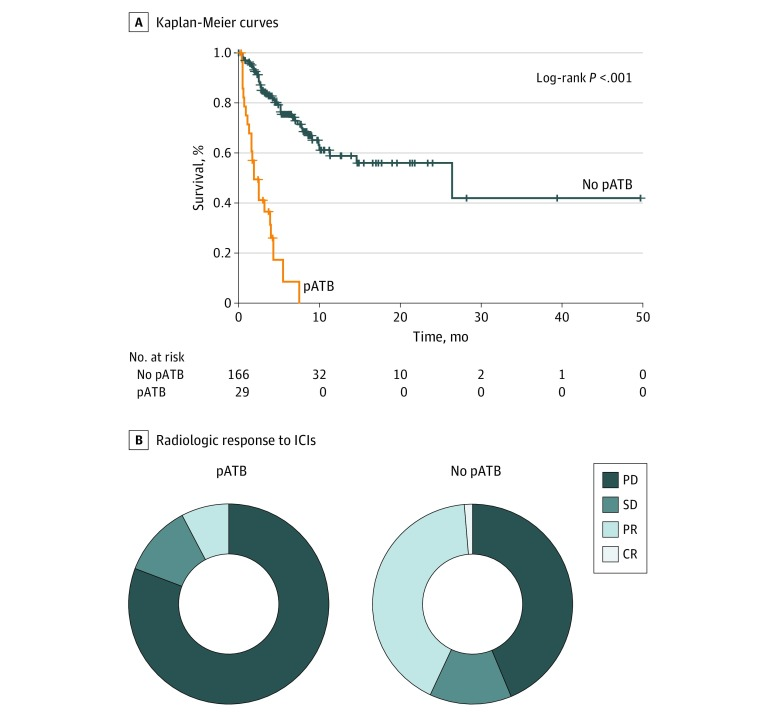
研究还发现[6]:在进行免疫检查点抑制剂抗体治疗之前接受广谱抗生素治疗的非小细胞肺癌、黑色素瘤及其它肿瘤患者的总生存期均显著低于未接受广谱抗生素治疗的患者。
2005年CELL的的一篇文章发现[7]:仅用BF单一定植,就可以恢复无菌小鼠(处于免疫失衡状态)脾淋巴细胞的CD4 T比例至正常水平;并使无菌小鼠的脾淋巴髓质细胞发育至正常小鼠水平;其荚膜PSA在体外与树突细胞共培养时,代表Th1的细胞因子IFNγ呈现出PSA剂量依赖性的增加;单独使用BF定植无菌小鼠,可减少Th2的细胞因子白细胞介素4(IL-4)的数量,即可纠正其Th2先天性偏倚的状况。
BFPSA(-)定植的无菌小鼠,其胸腺表现为CD19+B淋巴细胞过度增生,而有BFPSA(+)定植的无菌小鼠胸腺则与正常小鼠一致;胸腺CD19+B淋巴细胞过度增生常见于自身免疫病如重症肌无力[8],而B淋巴细胞的增生则是由Th2所调控的[9]。无菌动物和新生儿具有TH2倾斜的T细胞谱,表达比常规动物更高水平的TH2型细胞因子,这一异常可使宿主易患感染性疾病,过敏性疾病和炎症性疾病[10]。

在用BF定殖多发性硬化(一种自身免疫性疾病)鼠后,可以观察到颈淋巴结中Foxp3 + T reg细胞数量的增加[11]。Treg细胞通过多种机制发挥负性免疫调控作用,具有抑制自身免疫应答的重要作用。因此,BF能在调节免疫失衡状态下的Th1/Th2平衡和免疫耐受,对保持免疫稳态,治疗免疫失衡性疾病有极大潜力。
一般认为:细胞免疫是抗肿瘤免疫的主力,而适应性免疫更为重要[12]。适应性免疫效应细胞包括CD8+CTL、CD4+TH1等。如上所述:BF能增加无菌小鼠(处于免疫失衡状态下)CD4+TH1的数量,与抗PD-1抗体通过阻断PD-1通路、激活CD4+TH1介导的抗肿瘤免疫反应作用机理一致。
因此,BF理论上可以增强抗PD-1抗体的疗效。同时由于它可以增加免疫失衡状态下的Treg细胞,起负性免疫调节的作用[11],对PD-1抗体导致的免疫相关不良反应(主要表现为Treg不足的自身免疫反应)也有很好的作用,因此,BF也可以降低其副作用。这可以解释上述动物实验结果。
相关文献:
[5] Marie Vétizou etal.Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota.Science. 2015 November 27; 350(6264): 1079–1084
[6]Pinato DJ,etal.Association of Prior Antibiotic Treatment With Survival and Response to Immune Check point Inhibitor Therapy in Patients With Cancer.JAMA Oncol. 2019 Sep 12. [Epub ahead of print]
[7] Sarkis K. Mazmanian etal.An Immunomodulatory Molecule of Symbiotic Bacteria Directs Maturation of the Host Immune SystemCell, Vol. 122, 107–118, July 15, 2005 107-118
[8]Malhotra, V., Tatke, M., Khanna, S.K., and Gondal, R. (1992). Thymic histology in myasthenia gravis. Indian J. Chest Dis. Allied Sci. 34 117–121
[9] Zhang, G.X., Navikas, V., and Link, H. (1997). Cytokines and the Th1/Th2 polarization in mucosal immunity. Nat. Med. 8, 567–573. pathogenesis of myasthenia gravis. Muscle Nerve 20, 543–551.
[10] Smith, P.M. & W.S. Garrett. 2011. The gut microbiota andmucosal T cells.Front. Microbiol.2:111
[11] Ochoa-Rep ́araz, J.et al. 2010.Central nervous systemdemyelinating disease protection by the human commensal Bacteroides fragilis depends on polysaccharideA expression.J. Immunol.185:4101–4108.





