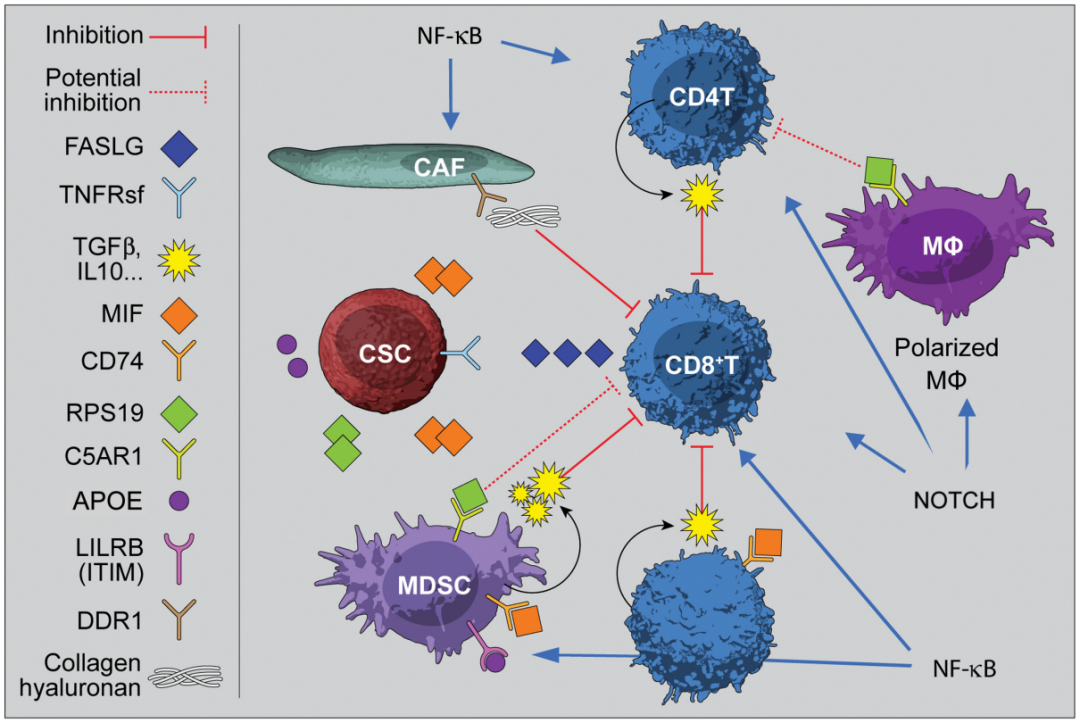
癌症细胞“改造”的免疫抑制微环境
癌症干细胞(cancer stem cells,CSC)来源于正常的干细胞。然而,CSCs也可以来自于经历了去分化或转分化的肿瘤细胞,它们可以被重新编程到不同的发育阶段。CSCs可以产生许多具有不同增殖能力、谱系损伤和表观遗传背景的子代,使得肿瘤获得免疫豁免权,形成抑制微环境。
干细胞与免疫豁免CSC的免疫豁免对传统化放疗耐受的癌症干细胞,发生应激反应基因的上调,以响应治疗。此外,CSCs与分化肿瘤细胞区分的显着特征是它们的免疫豁免权(immune privilege)。他们过表达某些表面标志物,屏蔽T细胞,NK细胞和巨噬细胞的作用。例如,SIRPa的过表达可以防止巨噬细胞通过CD47进行攻击,并且CD24与其T细胞和巨噬细胞上的受体Siglec-10(含有免疫抑制基序)相互作用。TIM3和PD-L1的上调降低T细胞活性。所有这些特征在功能上定义了难治性CSC。
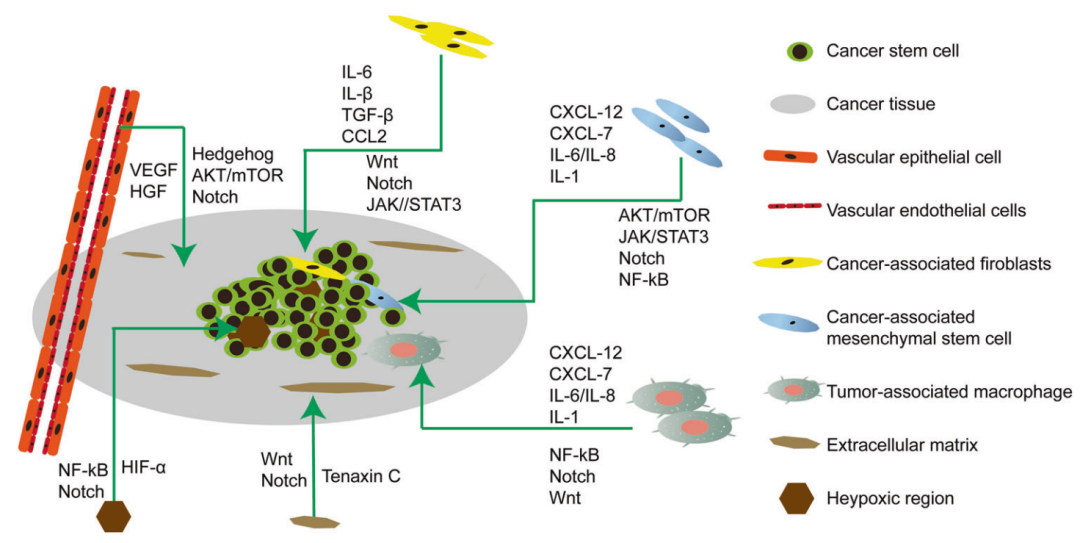
CSC信号通路
众所周知,几种发育调节途径,包括Wnt,Notch,Hedgehog,TGFb / BMP,FGF和PI3K / Akt,在CSCs的各种生物过程中起主要作用,包括自我更新,增殖,转移和治疗耐药性。
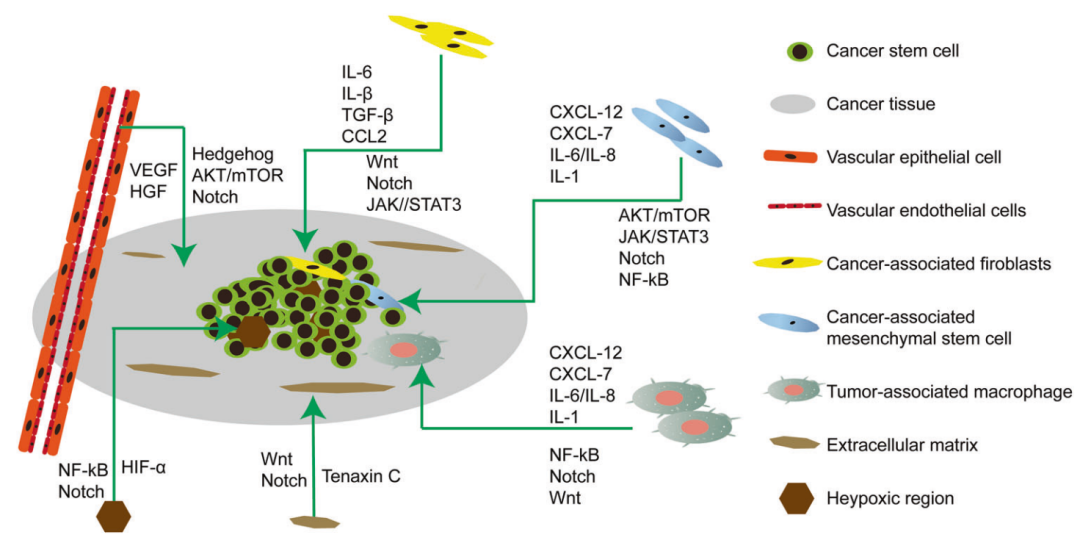
Signal Transduction and Targeted Therapy (2020) 5:8
CSC中的免疫逃逸调节直到最近才成为一个关键特征。TGFb上调通过抑制溶细胞免疫细胞来保护CSC。Wnt/b-catenin在CSC中增加,并与抗肿瘤免疫拮抗。从机制上讲,b-catenin可以直接与许多免疫检查点基因的位点结合,包括PD-L1,TIM3和CD24。增加CSC中的PI3K / AKT信号,可以通过b-catenin(Ser552 / Ser765磷酸化)上调这些免疫调节剂的表达。有趣的是,这种AKT依赖性免疫检查点基因的上调主要在白血病干细胞(LSC)中检测到,但在白血病原始细胞中没有检测到,这赋予了LSC免疫豁免权。MTDH-SND1复合物降低了编码抗原呈递机制关键成分的mRNA的稳定性,以抑制抗肿瘤T细胞反应。NF-kB广泛参与癌症中免疫细胞的调节,据报道NF-kB对许多生物CSC特性至关重要。此外,Hedgehog信号传导支持干细胞样表型,同时也促进肿瘤免疫耐受。CD200-CD200R被证明参与CSC的免疫逃逸。免疫抑制所涉及的信号通路在不同的组织和不同的癌症类型中有所不同。CSC和免疫抑制微环境CSC是难治性癌症的关键细胞群,是肿瘤再生的主要驱动因素。CSC与其相关生态位之间的直接相互作用是治疗耐药的重要因素,包括免疫抑制微环境的形成。
Nat Rev Cancer. 2021
癌症干细胞(CSCs)和髓系细胞之间通过可溶性介质或并列信号通路的相互通信促进了免疫抑制和干细胞性。CSCs驱动单核细胞和巨噬细胞,通过多种分子包括:CCL2、CCL5、CSF1、TGFβ、GDF15、WISP1、CSF1R、CCR2。反过来,巨噬细胞表达IL-6、IL-13、多营养因子和TGFβ等因子,这些因子通过受体型酪氨酸蛋白磷酸酶-ζ(PTPRZ1)和ephrinA型受体4(EPHA4)发出信号来支持CSCs。这些相互作用激活了下游的STAT3、AKT和NF-κB通路。CSCs也通过CD47的表达来逃避巨噬细胞的吞噬作用。CSCs通过MHC-G与免疫球蛋白样转录本(ILT)抑制性受体相互作用,干扰树突状细胞(DC)的成熟。耐受性树突状细胞释放CXCL12(CXCR4的配体),促进CSCs。这些相互作用导致了干细胞转录因子NANOG、OCT4、SOX2和MYC的激活。由单核细胞来源的髓系抑制细胞(M-MDSCs)产生NO激活CSCs上的Notch,IL-6信号通路增加STAT3的磷酸化。CSCs通过巨噬细胞迁移抑制因子(MIF)和CD74招募M-MDSCs。CSCs还能促进M-MDSCs中的精氨酸酶1和STAT3信号转导。CXCL5-CXCR2轴和G-CSF招募与肿瘤相关的中性粒细胞(TANs)和多形核MDSCs(PMN-MDSCs)。反过来,前列腺素E2(PGE2)和S100A9支持干细胞性。TGFβ在这个通信轴中具有双向作用。
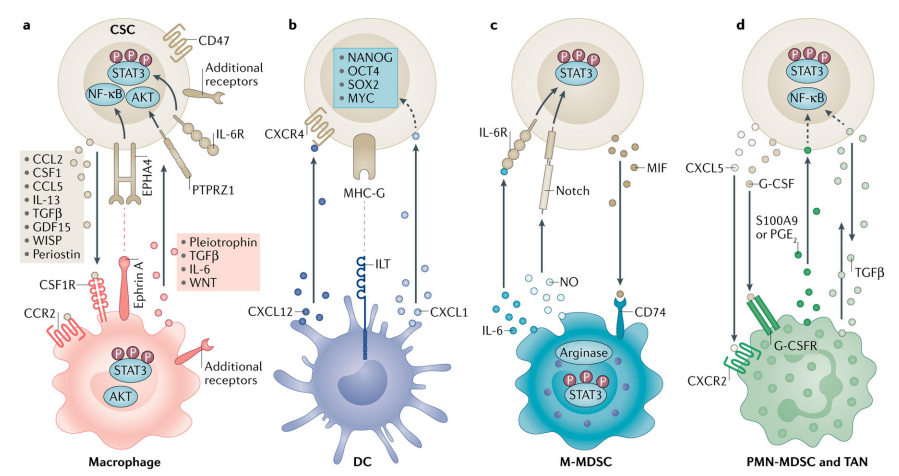
Nat Rev Cancer. 2021
肿瘤干细胞(CSCs)部分通过释放细胞外囊泡(EV)或游离的TNC,减少AKT和ERK信号通路,来抑制或逃避抗肿瘤T细胞。
CSCs还能诱导促进肿瘤的调节性T细胞(Treg细胞)和T辅助细胞17(TH17)。CSCs下调主要组织相容性复合体I类(MHC-I),并过表达检查点分子(包括PDL1等)。
CSCs通过CCL1、CCL2、CCL5、TGFβ和IDO1的组合,进一步驱动TH17细胞和Treg细胞的募集和极化。T细胞活性的另一层调节层是由免疫抑制髓系细胞间接介导的,包括巨噬细胞和M-MDSCs。这种作用部分取决于CSCs分泌的CCL1、CCL2、CCL5、IL-4、IL-6和IL-10。
髓系细胞产生额外的抑制分子,如检查点配体PDL1,以接触依赖的方式或通过促进Treg细胞来阻断T细胞的激活。
总的来说,这些相互作用重塑了肿瘤的免疫抑制微环境,并创造了一个由Treg细胞和TH17细胞支持CSCs的栖息地。
小结
总之,表型可塑性赋予CSCs固有的免疫特权,并促进外在免疫抑制屏障的形成。了解CSC中表型可塑性的细胞和分子机制为如何克服免疫特权和免疫抑制提供了有价值的信息。参考资料
Linheng Li and Roy A. Jensen,Understanding and Overcoming Immunosuppression Shaped by Cancer Stem Cells,Cancer Res 2023;83:2096–104 doi: 10.1158/0008-5472.CAN-23-0230Flores-Borja F, Blair P. Mechanisms of induction of regulatory B cells in the tumour microenvironment and their contribution to immunosuppression and pro-tumour responses. Clin Exp Immunol 2022;209:33–45.Mabrouk N, Lecoeur B, Bettaieb A, Paul C, Vegran F. Impact of lipid metabolism on antitumor immune response. Cancers (Basel) 2022;14:1850.Yang L, Shi P, Zhao G, Xu J, Peng W, Zhang J, et al. Targeting cancer stem cell pathways for cancer therapy. Signal Transduct Target Ther 2020;5:8Taniguchi S, Elhance A, Van Duzer A, Kumar S, Leitenberger JJ, Oshimori N. Tumor-initiating cells establish an IL-33-TGF-beta niche signaling loop to promote cancer progression. Science 2020;369:eaay1813Defne Bayik, Justin D. Lathia,Cancer stem cell–immune cell crosstalk in tumour progression,Nat Rev Cancer. 2021 August ; 21(8): 526–536. doi:10.1038/s41568-021-00366-w
来源:闲谈 Immunology 2023-08-04





