了解治疗中肿瘤标记物的变化趋势

决定一个癌症患者生存期和生存质量的原因有很多,而患者家属的因素占了一大部分。人们常认为在治疗的过程中,医生占主导地位。其实家属才是治疗过程中真正的主角,因为绝大部分的选择和决定权在家属手里(甚至不在患者手里)。患者家属不需要做到多么出色,哪怕仅仅是做到及格,也许就能延长亲人的生存期,提高生存质量,甚至挽救我们的亲人生命。【做一个合格的癌症患者家属】 |
近年来诸如“ctDNA检测”、“MRD检测”等所谓的高大上的新技术层出不穷,价格昂贵不说,效果也强差人意--只是给出一个可能性而已,所谓的统计学意义,无法对单个病例的疗效和预后做出准确预测。相比之下,方便又便宜的肿瘤标记物检测,却有着巨大的临床价值而没有被真正认识。医生对肿标的态度是矛盾的,既相信,又不相信。相信肿标主要是用在术后监控肿瘤复发转移,这个经过实践证明非常准,且比在影像上看到复发要提早两三个月。不相信肿标经常是在带瘤的治疗过程中。造成这种不信任的主要原因是看不懂。不同肿标之间的变化以及肿标与影像之间的变化往往难以统一解读,因此只能选择忽视。
如何解读这些肿标背后的含义是一个挑战,但是并不是说没有规律可循。肿标有参考价值是不争的事实,然而要看使用的框架:病例间的横向对比没有价值,但是在同一个病例中的纵向追踪就有意义。探论【什么是“探论”?-- 探论相对主流医学的区别和优势】经过数年的实战观察,表明肿标在一个具体的病例中不但是有规律的,而且对治疗有重要的指导意义。我们甚至可以根据肿标来判断靶向药是否能够长期有效,化疗应该什么时候做,肿瘤是否有PD-L1表达等等。
通过肿标指导靶向治疗
肿标反映的是肿瘤中不同部分的复制程度。比如说如果一个肿瘤中只有两个成份,一个自主复制和一个非自主复制。那么我们有可能看到两个敏感肿标,一个反映的是自主复制的活跃程度,另一个反映的是非自主复制的活跃程度。例如,在肺腺癌中,角蛋白19(Cyfra21-1)这个肿标代表的往往是自主复制的成份,而CEA代表的往往是非自主复制的成份。其他肿瘤也有一些相对特异的敏感肿标,往往也是代表了其中的自主复制成份。比如CA125是卵巢癌的自主复制肿标(而HE4,如果也同时存在敏感,可能就是非自主复制的肿标);CA153是乳腺癌中的自主复制指标(CEA往往是非自主复制的代表);CA199在胃肠道肿瘤中敏感,往往是自主复制的代表(而CEA,如果也敏感,则是非自主复制的代表);AFP则是肝细胞癌的自主复制代表(异常凝血酶原则往往代表了肝癌中的非自主复制成份)。从时间上看,自主复制肿标先动,非自主复制肿标后动。不管是升高还是降低都有一个联动和滞后,因此连续检测肿标的时候就有可能赶上两个肿标走势不一致的现象,变得不知道该相信哪一个。比如下面这张图中,一次化疗6-7周后,自主复制肿瘤开始再次活跃,此时看到的非自主复制还在低位,但是等到二次化疗后自主复制再次下降的时候非自主复制已经开始升高了。往往就是这种滞后导致了主流医生看不懂肿标走势,完全不理解发生了什么。

有时在一个肿瘤中会出现多个代表自主复制的敏感肿标,这些敏感肿标反映的是肿瘤异质化所产生的不同成分。一个病例的敏感肿标越多,其肿瘤异质化程度越复杂。从判断靶向药的有效性来看,很少有一个靶向药能够同时控制几个异质化成份的可能。也就是说不管基因检测怎么说,只要一个病例同时存在两个或者两个以上自主复制成份的情况下,大概率是天生耐药,靶向药不可能长期有效。还有一种情况是在肿瘤的进展过程中出现了新的敏感肿标,这就意味着肿瘤很可能出现了新的异质化成分,而新出现的这部分往往既不能被靶向药控制也不能被免疫控制。我们经常可以通过观察肿标是不是联动来推测肿瘤的复制是不是相关(下图)。
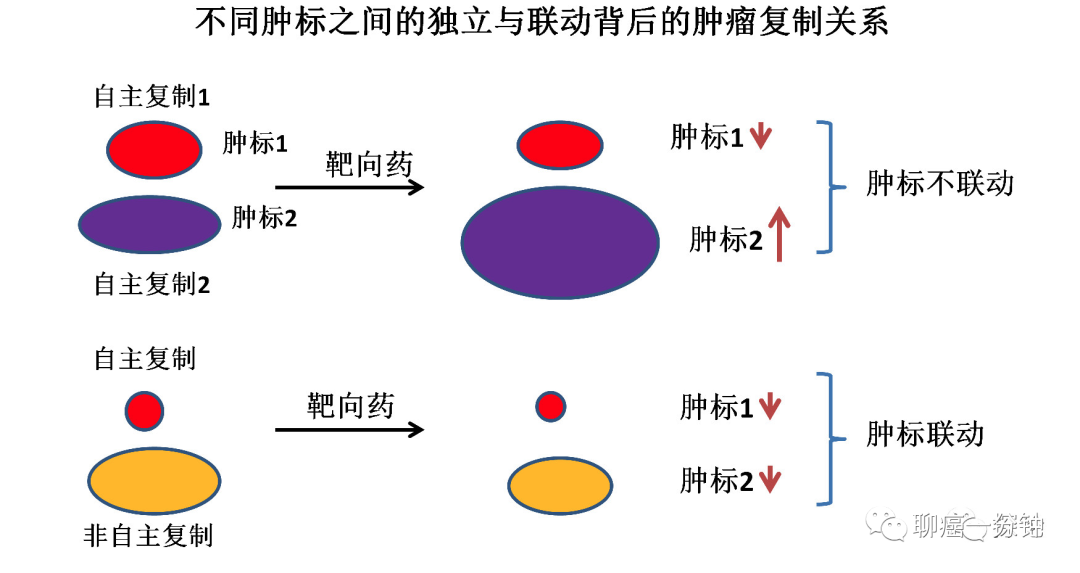
通过肿标指导化疗
肿标所反映的肿瘤复制程度有两个含义:一个是复制中的细胞数量;另一个是单个细胞复制的快慢。后者对肿标的贡献率远大于前者。也就是说肿标升高代表的更多是肿瘤复制加快,而不是肿瘤负担有多大(当然肿瘤也会长大,但并不跟肿标升高的数值呈比例)。在极端的情况下,有可能很少几个细胞的高速复制就能产生剧烈的肿标升高;而一个并不算小的肿瘤虽然也在低速复制,肿标升高的幅度却并不大。因为共存免疫的功能之一就是限制肿瘤的复制,所以在有共存免疫存在的情况下,肿标的变化反映的就是共存免疫的功能和对肿瘤的控制程度。所以才可能通过肿标的变化来跟踪背后共存免疫对不同肿瘤成份的控制程度。
掌握了这个原则,在分析肿标变化时就可以找到这个规律。凭这些肿标的变化,我们可以看到肿瘤复制的变化,而肿瘤复制的变化背后就有免疫的影响。如果一个肿瘤有共存免疫,很可能这个肿瘤的自主复制就会受到免疫的影响。即便是没有任何治疗的情况下,我们也可以看到一个病例中肿标的自发下降。这种情况往往表明共存免疫的建立和与肿瘤达成的平衡。很多情况下,这才是开始化疗的时机。
因为化疗本身的杀伤是短期和即时的,只发生在化疗给药的最初几天,所以在那个阶段会看到肿标快速下降。因此我们常常需要在化疗给药的第7天检测肿标以确认化疗是否造成了直接杀伤(医院从来不在这个时间点测肿标,因此也看不到这个变化)。随着化疗的直接杀伤结束,再加上化疗造成的炎症对肿瘤复制的刺激,肿标的自然走势就应该是止跌回升才对(下图中“直接杀伤”)。然而在有共存免疫的情况下,化疗杀死的肿瘤会释放抗原,激活共存的免疫,而激活的免疫进一步参与对肿瘤的压制,反映到肿标上就是持续下降(下图,免疫激活)。因此持续的肿标下降就间接告诉我们有免疫激活和参与了对肿瘤复制的打压。在很多情况下,即便是不再进行化疗,这个持续的肿标应答会持续至少数周,说明免疫激活后的疗效是持久的。因此我们需要在化疗后持续检测肿标(每2周一次),以确认是否有免疫参与,而不是按照指南闭着眼睛每21天连续化疗。

随着抑制肿瘤的复制和一部分肿瘤的死亡,在后面的影像检查中就会看到对应的肿瘤缩小。虽然这个持续的应答是好事,但是在这个过程中,肿瘤的复制会处于较低的水平,这个低复制会造成再化疗的失效(因为化疗只能杀死高复制的肿瘤细胞)。这时候如果坚持用原来的化疗方案,就会发生不但杀不死肿瘤,还会杀死免疫(白细胞)的情况。反映在肿标上就是化疗后肿标不再下降,甚至出现应答的反弹(上图的“免疫僵持”),这就是主流认为的耐药了。如果能够提前预测这个结果,我们就不会盲目的再用同样的化疗去尝试了。通过化疗后产生的肿标的反弹和之后的走势,探论往往可以推测出反弹的原因是不是因为共存免疫控制了肿瘤的复制。
抗肿瘤的共存免疫往往可以抑制肿瘤的复制,但是在一些共存免疫较强的时候,也会诱导肿瘤细胞表达PD-L1,反映在肿标上,就是肿标大幅反弹甚至激升。这就是利用肿标来判断PD-L1表达的方法(上图的“免疫耐受”)。我们如果能够正确掌握这些线索,就可以在治疗中做出准确的判断和提前应对。
医生的迷茫
了解了这些条规律,就能理解临床上为什么看不懂肿标变化了。上面所描述的是比较简单和典型的情况,在实际的临床中情况是复杂而多变的。导致肿标在医生眼中迷惑不清的主要原因就是两个:一个是肿瘤的成份和复制模式的不同;另一个就是影响肿标变化的共存免疫不同。比如在一个肿瘤中可能同时包含很多种自主复制成分,以及每个人的共存免疫状态都不同而且时常变化。靶向药可能只能控制肿瘤中的一部分成分,而共存免疫识别的可能也只是多个成分中的某一个或者两个。受免疫或靶向药控制的成份在治疗中会下降,而不受控制的成份可能不会下降,或者受直接杀伤下降后再反弹。这样在同一个时间点去看这些肿标就显得七上八下的,不知道要相信哪个了。这样的情况在实践中经常发生,搞得医生一会儿觉得肿标可以帮助判断,一会儿觉得无规律可循,最后干脆放弃了。而探论正是因为搞明白了肿标所代表的是什么,所以可以掌握一个病例治疗路径上的正确选择。
然而,并不是所有的病例都会有已知的敏感肿标可供跟踪。这个并不说明这些病例没有敏感肿标,只是没有我们知道的常见的那些。有时候因为不可能全部筛查,甚至可能有已知的敏感肿标,只是没有做筛查。这也是为什么我们有时候会建议扩大搜索范围来寻找敏感肿标。从我们数年的实战中我们观察到没有常见敏感肿标可供跟踪的病例不到10%,就是说大部分时候还是可以跟踪敏感肿标的。
最后,关于肿标到底是怎么产生的,到底如何代表了肿瘤的复制程度还是一个没有回答的问题。探论的实际观察表明肿标的变化代表的总是肿瘤复制程度的变化,而不是肿瘤死亡的反映。就是说,如果化疗后我们看到肿标的下降往往说明化疗有直接杀伤。特别是一些复制高度活跃的肿瘤(比如小细胞癌,肠癌,卵巢癌等),在没有共存免疫存在的情况下,化疗后可以看到肿标的大幅下降,伴随的是肿瘤细胞的大量死亡,病灶的明显缩小。即便是化疗后的短期(2-4天内)监控,也看不到肿标伴随肿瘤细胞死亡的大幅升高,证明我们测试的肿标不是肿瘤死亡释放出来的产物,而是活的肿瘤细胞复制活动中的某个(直接或者间接)产物。尽管肿标本身的一些秘密一直没有解开,这并不妨碍我们对肿标的跟踪和解读。至少到目前为止,探论对肿标的解读绝大多数时候都可以通过后续的病情走势来证实是正确的。
来源:聊癌一分钟 2023-03-16
阅读原文阅读 323





