14种衰老模型的特点
衰老是一种机体组织、器官、细胞多维度稳态失衡、功能退化的过程,其诱因复杂、表现多样,使人们对衰老的研究需要利用各种模型来模拟人体生理、病理过程,以此来揭示衰老机制,指导抗衰老策略。
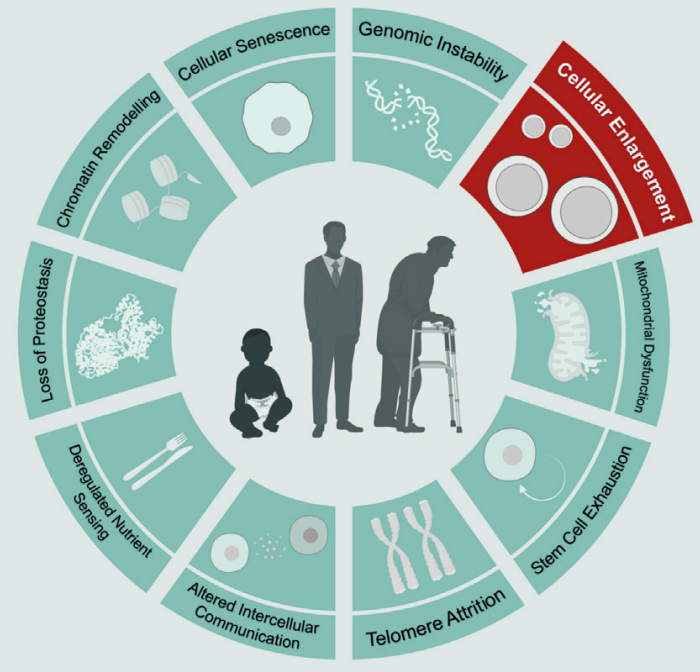
衰老的特征(Front. Cell Dev. Biol. 2022)
体外模型
| 类型 | 特征 | |
复制性衰老: RS | 复制衰老模型 | 饱和密度降低,细胞表面积、体积增加, 细胞周期停滞,端粒缩短。 |
化疗诱导衰老: CIS | 羟基脲诱导 | ROS增加, 细胞增殖减少。 |
Aβ1-42寡聚体 AD模型 | ROS增加, PAI-1和p21的mRNA水平升高, SIRT1水平降低。 | |
| D-半乳糖诱导 | ROS增加,炎症水平升高, p16、p21、p53基因表达增加, NRF2、HO-1减少。 | |
阿霉素诱导 (DAN拓扑异构酶抑制剂) | 细胞周期停滞,DNA损伤增加,端粒缩短, p16lnk4a基因表达增加。 | |
Palbociclib诱导 (CDK4/CDK6抑制剂) | G0/G1停滞,细胞生长停滞 Rb蛋白表达减少, IL-6、IL-8、CXCL1分泌增加。 | |
应激诱导早衰: SIPS | X射线诱导 | 不可逆的G1周期停滞,DNA损伤, IL-1β、IL-6、IL-8分泌增加 |
| 紫外线(UVB)诱导 | 生长停滞,线粒体DNA缺失 衰老相关基因表达增加。 | |
| H2O2诱导 | G1期停滞,端粒缩短, p21、gadd45基因表达增加 | |
| t-BHP诱导 | 生长停滞, 线粒体DNA 4977-bp片段缺失, p21waf-1过度表达,Rb蛋白磷酸化受阻, 衰老基因表达增加。 | |
| 乙醇诱导 | 生长停滞, 线粒体DNA 4977-bp片段缺失, p21waf-1过度表达,pRb无法磷酸化 衰老相关基因表达增加。 | |
| 高氧诱导 | G1期停滞,端粒缩短, 蛋白降解增加,脂褐质/蜡样质积累。 | |
癌基因诱导衰老: OIS | Mos-过表达模型 | 生长停滞,DNA损伤, p16INK4a上调, SA-β-gal阳性染色增加。 |
| B-RAF V600E模型 | 细胞周期停滞, p16INK4a上调, SA-β-gal阳性染色增加。 | |
| H-RAS G12V模型 | p16INK4a上调,Rb磷酸化程度降低, SA-β-gal阳性染色增加。 | |
| 抑制DNA甲基转移酶 | 5-aza-2'-脱氧胞苷诱导模型 | 生长抑制, p16表达增加, p53表达减少。 |
| 抑制端粒酶活性 | SYUIQ-5诱导 | 生长抑制, p16、p21、p27表达增加。 |
| 细胞周期蛋白E过表达 | 细胞周期停滞,DNA损伤增加。 | |
| IMR90 ER: RAS模型 | 生长停滞, 衰老相关分泌表型(SASP)标志物表达增加。 | |
| 来自老年捐赠者 | 具有衰老表型的iPSC衍生神经元 | 来自老年供体的iPSC衍生神经元,具有衰老相关基因表达。 |
具有衰老表型的诱导神经元 | 来自老年供体成纤维细胞,具有年龄更依赖型转录组特征。 | |
体内模型
| 类型 | 特征 | |
快速衰老模型 SAMP | SAMP6: 老年骨质疏松模型 | 骨形成减少,骨髓脂肪增加, PPARγ、Sfrp4表达增加。 |
SAMP8: AD模型 | 年龄相关的学习、记忆障碍, Aβ沉积,自噬功能异常。 | |
SAMP10: 神经退行性病变 | 自发性大脑退化,学习、记忆、情绪障碍。 | |
| 理化因素诱导模型 | D-半乳糖 | ROS增加,炎性水平升高, 线粒体功能障碍,细胞凋亡增加, p21、p53基因表达上调。 |
| AICI3 | 认知功能显著降低,短期记忆受损、焦虑加剧、空间和参考记忆下降。 | |
D-半乳糖+AICI3 | 记忆缺陷, 神经元损伤, 海马区caspase-3过度表达。 | |
D-半乳糖+NaNO2 | 认知、记忆障碍, 氧化应激增加, 海马CA1、CA3、CA4区神经元损伤, 精子质量下降,睾丸形态恶化。 | |
| 铁辐射感应 | 持续性DNA损伤反应, SASP标记增加,IL-8产生增加。 | |
| O3诱导 | 胸腺萎缩,体重减轻,探索活性减少, 氧化损伤增加。 | |
Wrn基因敲除: Werner综合征 | Wrn-/-,Trec-/- | 白发,脱发,白内障,骨质疏松,T2D, 端粒缩短。 |
| Wrn△hel/△hel | 严重的心脏间质纤维化,胰岛素抵抗,高甘油三酯血症,癌症发病率增加, ROS增加,DNA损伤增加。 | |
Lmn突变: HGPS | Lmna L530P/L530P | 严重生长迟缓,脱发,骨质疏松,肌肉萎缩。 |
Lmna HG/+ | 生长缓慢,骨质疏松,脱发,偏脂营养不良。 | |
| lmna G609G/G609G | 不孕,体重减轻,生长迟缓,脊柱弯曲,血管钙化,骨密度降低, 胰岛素样生长因子减少。 | |
| Zmpste24 -/- | 严重生长迟缓,扩张性心肌病,脂肪营养不良,肌肉营养不良,过早死亡。 | |
| 其他基因相关模型 | BubR1 H/H | 大脑胶质增生、白内障、心率失常,皮肤变薄,血管弹性降低,纤维化受损。 |
Ndufs4 -/- | 利氏综合征相关神经退行性改变,嗜睡,共济失调,体重减轻,过早死亡。 | |
ERCC1 -/- ERCC1 △/- | 生长迟缓,共济失调,视力丧失,小脑发育不全,脑病,肾功能衰竭。 | |
Sod1 -/- | 白内障,听力丧失,皮肤变薄,脂质代谢紊乱,伤口愈合缺陷。 | |
| Klotho -/- | 心血管损伤,动脉硬化,皮肤萎缩,肺气肿 | |
| Xpd TTD/TTD | 骨质疏松,骨质硬化,脊柱后凸, 恶病质,白发,不育,寿命缩短。 | |
mtDNA Polγ突变 (PolG) | 体重减轻,脱发,听力丧失,骨密度的降低,贫血,心肌病。 | |
| PolgA mut/mut | 骨质疏松,脊柱侧弯,贫血,心脏增大,生育能力降低。 | |
| Nfkb1 -/- | 骨质疏松,脊柱后凸,骨质疏松,组织炎症,中枢神经系统神经胶质增生,寿命缩短。 | |
| Terc -/- | 器官功能受损,组织萎陷,生育能力降低,寿命缩短。 | |
3xTg-AD AD模型 | 记忆障碍,认知缺陷, 突触功能障碍,海马神经元异常兴奋,淀粉样斑块和p-Tau沉积。 | |
Tg2576 AD模型 | 认知障碍,记忆丧失, 氧化性脂质损伤,大脑炎症。 | |
| 长寿动物 | 裸鼹鼠 | 寿命长,健康,死亡率低。 |
| 涡虫 | DNA修复机制高效,端粒酶活性强,具有非常好的再生能力,被认为是永生的。 | |
| 蝾螈 | 清除衰老细胞能力、再生能力强。 | |
| 乌龟 | ROS清除速度快,端粒酶活性强,DNA修复机制高效。 | |
| 转基因延缓衰老 | Ames侏儒鼠, Prop1 df/df | Prop1基因隐性点突变, 垂体发育受损,体型变小, PI3K-Akt-mTOR通路下调。 |
Snel侏儒鼠, Pit1 dw/dw | Pit1基因自发突变, 垂体发育受损,体型变小,免疫衰老减少。 | |
参考资料
Carrasco, E. et al. The role of T cells in age-related diseases. Nat. Rev. Immunol. 22, 97–111 (2022).
decline in ageing. Nature 590, 122–128 (2021). 56. Brauning, A. et al. Aging of the immune system: focus on natural killer cells phenotype and functions. Cells 11, 1017 (2022)
Franco, A. C., Aveleira, C. & Cavadas, C. Skin senescence: mechanisms and impact on whole-body aging. Trends Mol. Med. 28, 97–109 (2022).
Sabbatini, M. et al. Aging hampers neutrophil extracellular traps (NETs) efficacy. Aging Clin. Exp. Res. 34, 2345–2353 (2022)
Li, X., Li, C., Zhang, W. et al. Inflammation and aging: signaling pathways and intervention therapies. Sig Transduct Target Ther 8, 239 (2023). https://doi.org/10.1038/s41392-023-01502-8
van de Wal, M. A. E. et al. Ndufs4 knockout mouse models of Leigh syndrome: pathophysiology and intervention. Brain 145, 45–63 (2022).
Davies DM, van den Handel K, Bharadwaj S and Lengefeld J (2022), Cellular enlargement - A new hallmark of aging? Front. Cell Dev. Biol. 10:1036602. doi: 10.3389/fcell.2022.1036602
来源: 闲谈 Immunology 2023-07-18





