抗体的多特异性
抗体药物的多特异性是指抗体药物和非药物靶点发生的特异性反应(与脱靶效应类似)。早在1990年,Stern和他的同事就发现单克隆抗β-淀粉样肽抗体可与外周血中人纤维蛋白原结合,可能原因是二者的构象同源性(文献1)。之后开展的临床前及临床试验显示,多特异性会影响药物的PK,增加毒性的发生率。
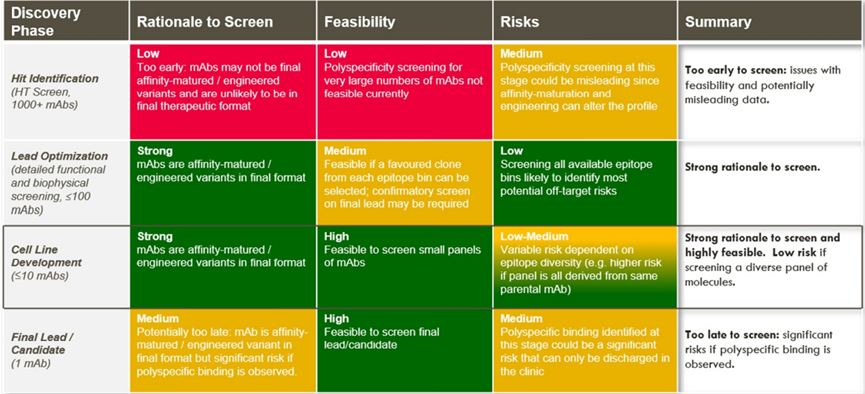
细胞株开发阶段进行多特异性筛选可能是最好时机
MAbs. Jan-Dec 2021;13(1):1999195.
产生多特异性的三个结构驱动因素除了序列同源性是比较容易理解和预测的多特异性产生因素,下面三个因素则比较难以通过模型或者实验进行预测。分子拟态分子拟态,即抗体可以与不同蛋白质结合,但是结合的蛋白质之间没有明显的整体序列同源性,仅关键的表位残基可能出现在一个完全不相关的蛋白质中。Tucker等人的工作就证明了这一点,他们首先进行鸡体内免疫,使用体外噬菌体展示获得抗GLUT4抗体。结合能力分析,与膜表达的GLUT4表现出高亲和力,但与密切相关的人类GLUT1、GLUT2、GLUT3或小鼠GLUT1没有结合。但是对4571个受体的膜蛋白阵列筛选显示,与Notch-1的亲和力较低,但呈剂量依赖,为特异性结合。GLUT4和Notch-1蛋白同源性小于7%,但是抗体结合的关键残基GLUT4 (61-LGXXGP-66)出现在 Notch-1 (91-LGXXGP-96).
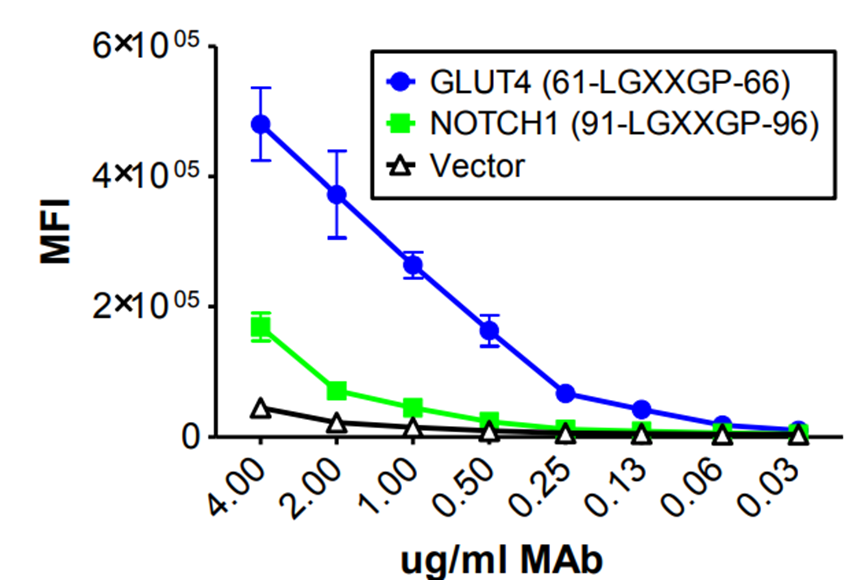
MLUT4抗体特异性结合NOTCH1(Proc Natl Acad Sci U S A. 2018;115 (22):E4990–E9.)鉴于分子拟态是感染源逃避宿主免疫反应的共同特征,识别病毒和细菌靶点的抗体多特异性的风险更高。文献已经报道过几个这样的例子,包括结合心磷脂的抗HIV抗体,识别LYRIC蛋白的抗登革热NS1抗体,以及针对肌球蛋白的A组链球菌M蛋白的抗体。CDR可塑性第二种分子机制为CDR可塑性。抗体的抗原结合区域有多种构象,例如,4E10是一种广泛中和的抗HIV抗体,它针对包膜糖蛋白的膜近端区域的一个高度保守的线性表位,但发现可以识别自身抗原。在寻找其结合的自身抗原时,使用了一个噬菌体展示肽库,在确定的前5个结果中,3个为1、2和3型肌醇三磷酸受体,它们都共享一个保守的肽序列基序。但该序列与MPER上的4E10核心表位完全不同,考虑和H-CDR3环构象灵活性相关。
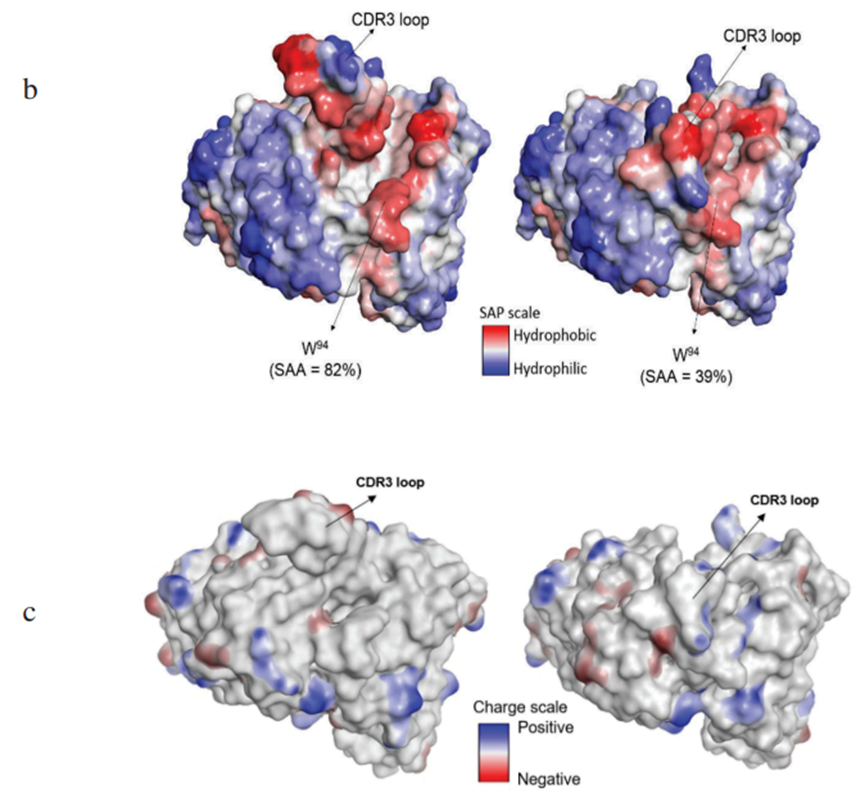
“开放”和“闭环”构象的分子建模结果的比较(MAbs. 2020;12(1):1763138)CDR突变可引入多特异性多特异性的第三个结构驱动因素并不依赖于共同基序或构象灵活性,而是通过VL和VH CDR的差异与两个不相关蛋白的相互作用。换句话说,根据他们结合的蛋白质不同,单个抗体可能有多个(潜在重叠的)功能抗体结合区域。trastuzumab (Herceptin®)已被证明主要通过重链介导与人类表皮生长因子受体2(Her2)的相互作用。轻链中的突变获得了与第二个不相关的抗原VEGF的高亲和力结合的变异。结构和功能分析表明,这些变体之一bH1-44和两个完全不相关的抗原之间的相互作用是不同的,其特征是中心结合位点的构象适应。
值得注意的是,bH1-44重链上的两个突变足以敲除Her2的结合,同时保持与VEGF的高亲和力。同样,bH1-44轻链中的2个丙氨酸取代,破坏了VEGF的相互作用,而对Her2的接触没有影响。即使是最小的突变也可能导致如此显著的特异性差异,引入突变是不是需要慎之又慎?简评:除了序列同源这一因素比较容易被预测,本文列举的剩余三个因素:分子拟态、CDR可塑性、以及突变引起的结合特异性改变,都不太容易通过模型预测。
参考文献:
Stern RA, Trojanowski JQ, Lee VM. Antibodies to the beta-amyloid peptide cross-react with conformational epitopes in human fibrinogen subunits from peripheral blood. FEBS Lett. 1990;264 (1):43–47. doi:10.1016/0014-5793(90)80760-G.
Tucker DF, Sullivan JT, Mattia KA, Fisher CR, Barnes T, Mabila MN, et al. Isolation of state-dependent monoclonal antibodies against the 12-transmembrane domain glucose transporter 4 using virus-like particles. Proc Natl Acad Sci U S A. 2018;115 (22):E4990–E9. doi:10.1073/pnas.1716788115.
Lan W, Valente JJ, Ilott A, Chennamsetty N, Liu Z, Rizzo JM, Yamniuk AP, Qiu D, Shackman HM, Bolgar MS, et al. Investigation of anomalous charge variant profile reveals discrete pH-dependent conformations and conformation-dependent charge states within the CDR3 loop of a therapeutic mAb. MAbs. 2020;12(1):1763138. doi:10.1080/ 19420862.2020.1763138
Bostrom J, Yu S-F, Kan D, Appleton BA, Lee CV, Billeci K, Man W, Peale F, Ross S, Wiesmann C, et al. Variants of the antibody herceptin that interact with HER2 and VEGF at the antigen binding site. Science. 2009;323(5921):1610–14. doi:10.1126/ science.1165480.
Orla Cunningham et al,Polyreactivity and polyspecificity in therapeutic antibody development: risk factors for failure in preclinical and clinical development campaigns,MAbs. Jan-Dec 2021;13(1):1999195.
来源:闲谈 Immunology 2023-03-08




