CRISPR基因编辑猪器官成功移植猴子身上
eGenesis在2023年美国移植大会(ATC)报告了基因工程改造的猪供体实现了异种器官长期非临床移植,其新发现为异种器官移植前瞻性临床试验的进一步评估奠定了基础。
1954年12月23日,美国成功进行世界第一例人体器官移植。此后,随着器官移植技术飞速发展,器官移植已成为肾功能衰竭和其他器官疾病患者的切实选择。据2022年世界卫生组织(WTO)统计,全球每年进行超过15万例实体器官移植,其中有超10万例的肾脏移植。对肾功能衰竭患者而言,肾移植为优先选择。
而目前的可移植器官却是供不应求,随着全球老龄化速度加快,可移植器官也越发稀缺,其医疗需求未得到满足。为了应对这些挑战,不少研究机构也在不断推进可移植器官的相关研究,其中异种器官移植吸引了一批科学家的关注,但这种设想面对着一只“拦路虎”——排异反应。
1905年,法国开创了世界第一例异种器官移植手术,手术成功将一个兔肾植入一位肾功能衰竭的儿童体内。手术成功了,但在16天后,由于排异反应,儿童死于肺部感染。自此经过几十年的摸索,科学家们发现同为灵长类动物的猪的细胞外基质(ECM)与人的同源性超过93%,可以显著降低排异反应的出现,异种器官移植研究得以推进。与此同时,随着CRISPR等基因编辑技术的兴起,异种器官移植也有了新的方向,通过基因修饰达到异种抗原消除、人类转基因(TG)的表达和逆转录病毒失活等方面,以提高异种器官的相容性和安全性。eGenesis的科学家对猪供体进行了基因工程改造,使用CRISPR基因编辑技术去除三种已知的与超急性排斥反应有关的异种抗原(3KO),转入了适应性免疫调节和凝血相关的功能基因,并使猪内源性逆转录病毒失活。
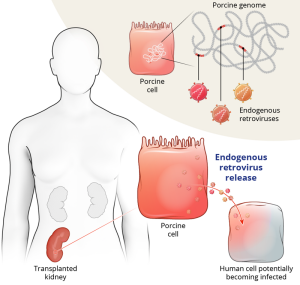
▲ 图片来源:eGenesis
在本次汇报中,eGenesis的口头报告充分展示了关于异种器官移植的各项免疫反应最新进展。
结论1. 表达人类基因的转基因猪肾可使猕猴受体存活超2年
与接受含有3KO的异种移植受体相比,移植含有TG的猪供体移植物时,猕猴受体的存活率显著提高,中位存活时间为24天对176天。其中在长期存活受体中,一个受体存活超过两年,两个超过18个月。
结论2. 转入TG基因,敲除3KO基因可加长异种肾脏存活时间
预先形成的抗猪抗体可能不利于异种移植物的存活,通过CRISPR基因编辑技术敲除三个异种抗原(3KO)基因的猪细胞已被证明在体外可显著降低天然存在的供体特异性抗猪抗体(DSA)的结合。而加入与适应性免疫调节和凝血有关的TG基因,也改善和延长了异种移植物的存活率。
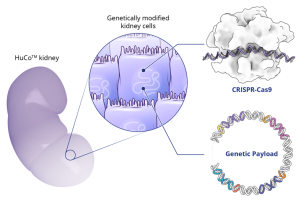
▲ 图片来源:eGenesis
实验结果表明,在非人灵长类动物受体中,与仅表达3KO的异种肾脏相比,含有3KO和TG插入的异种肾脏存活时间明显增长。而移植前DSA和异种存活率之间并没有观察到明显的相关性。
结论3.抗SLA抗体并非AMR产生的主要原因
抗体介导的排斥反应 (AMR)是异种器官移植失败的主要原因,其中受体抗体靶向供体猪白细胞抗原(SLA)的程度在很大程度上仍旧未知。为了确定SLA在AMR中的作用,研究团队从接受移植后的受体收集血清样本进行SLA抗体的筛选。研究数据发现14名受体中有6名产生了针对SLA的抗体,但多数猪反应性抗体与非SLA抗原结合。此外,在没有检测到SLA靶向的情况下也有引起高水平的抗猪抗体,这些数据表明SLA本身不是大部分的排异反应来源。
供体无细胞DNA(dcfDNA)已被提议作为移植实体器官中免疫排斥反应的预测生物标志物,作为评估移植物健康的指标。实验数据表明长期幸存者表现出较低的dfcDNA水平。

eGenesis成立于2015年,由哈佛大学 George Church 院士和杨璐菡博士共同创立,致力于通过基因编辑和基因工程技术研发人类兼容的器官、组织和细胞。2017年3月,eGenesis完成了3800万美元的A轮融资,并于2019年11月完成了1亿美元的B轮融资。
截止目前,eGenesis通过使用CRISPR/Cas基因编辑技术成功抑制了猪内源性逆转录病毒(PERV)的表达,解决了病毒风险和跨物种分子不相容的问题。迄今为止,eGenesis已经证明了持久性的临床前成功,并且正在推进急性肝衰竭、肾移植和心脏移植的开发计划。
结语
eMedClub
关于异种器官移植的大胆构思,无疑被许多人寄予厚望,其成功后的可观成果令人振奋,但其所面临的安全性和有效性问题,也需要时间去探索。随着技术的不断发展,异种器官移植或成为患者的选择。
参考资料:
1.https://www.biospace.com来源:医麦客 2023-06-09





