开发人造抗病毒免疫样系统

新型广谱抗病毒免疫样ALICE系统(图片由研究团队提供)随着全球气候变暖,未来全球将面临更多新发或再发病毒引发的传染病疫情。此前的埃博拉病毒、甲型H1N1流感、寨卡病毒、以及最近的新冠病毒肺炎(COVID-19)疫情,都对全球的经济、公共卫生安全、以及人类健康,产生了巨大冲击。除此类突发病毒外,长期潜伏于机体的病毒,如人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)、人乳头瘤病毒(HPV)以及单纯疱疹病毒1型(HSV-1)等,也因其高传染性和反复发作的特点,较难防治。因此,迫切需要建立针对病毒感染的广谱性抗病毒新策略。但是现有的病毒检测和清除策略均分开独立进行,尚未有集病毒检测和清除为一体的工程化系统。这促使我们设计开发针对病毒的闭环式基因线路,实现体内病毒检测清除一体化、自动化和智能化。

2022年12月9日,Nature Communications刊登了华东师范大学叶海峰研究员团队和杜克-新加坡国立大学医学院王林发院士团队,历时8年在抗病毒免疫领域的最新研究成果Engineering antiviral immune-like systems for autonomous virus detection and inhibition in mice。研究团队设计了一组集病毒检测清除于一体的闭环式免疫样系统ALICE。该系统成功模拟了人体的抗病毒免疫系统,能够自动感应和破坏入侵的病毒(图 1)。该系统以感知外源核酸的STING蛋白为接头,连接人工搭建的信号反应网络,同步输出多重抗病毒功能模块(包含抗病毒细胞因子IFN-α和IFN-β、降解病毒核酸的CRISPR-Cas9、抗病毒中和抗体)。当病毒入侵时,ALICE系统能够自动感知,并同步输出抗病毒功能蛋白,发挥抗病毒效果。
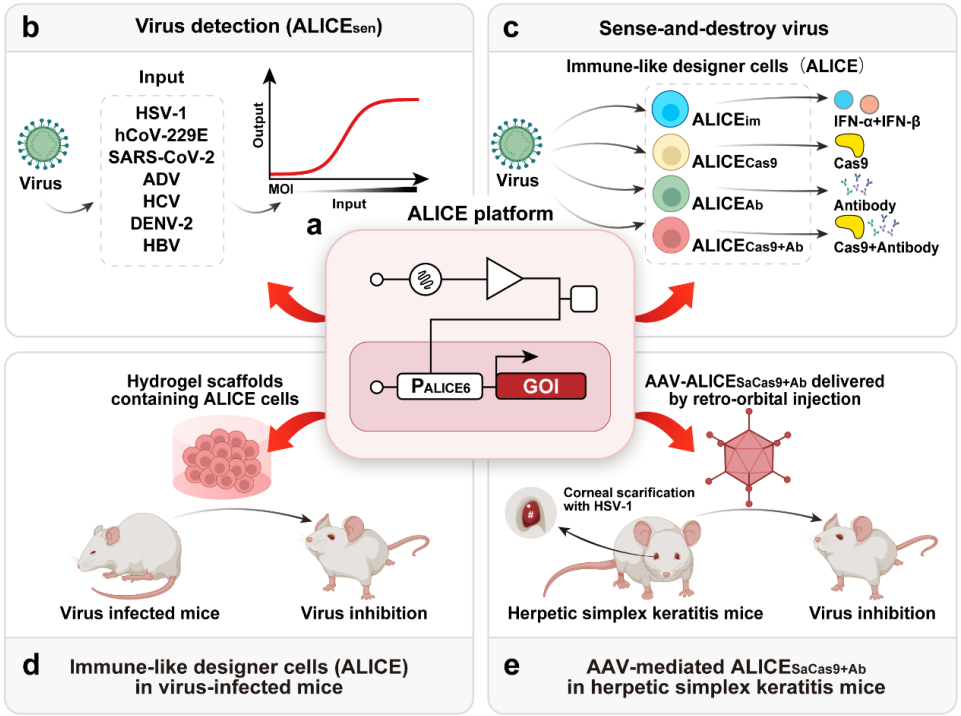
图1 ALICE系统简介
1. 自动感应病毒入侵的ALICEsen传感器
研究团队首先设计构建了ALICEsen传感器,用于测试系统感知病毒的广谱性。通过对ALICEsen传感器中的接头蛋白STING、信号级联传递的操纵子序列/启动子序列进行优化,最终成功实现STING-依赖的七类病毒的广谱性响应。研究团队后续选取HSV-1作为模式病毒,对系统的动力学特征进行探究,发现ALICEsen传感器具有很好的病毒剂量依赖、病毒感染时间依赖以及在不同细胞系中有良好的普适性。
2. 设计构建自动感应和清除病毒的ALICEim系统
研究团队在ALICEsen传感器的基础上,将输出模块中的报告基因替换为具有抗病毒功效的IFN-α和IFN-β,组装自动感应和清除病毒的ALICEim系统。实验结果显示,ALICEim系统一旦发现病毒入侵,立即启动IFN-α或IFN-β的表达,快速清除病毒。ALICEim系统成功模拟了人体的第一道免疫防线——固有免疫系统的抗病毒效果。
3. 设计构建自动感应和降解病毒基因组的ALICECas9系统
为了进一步清除潜伏在人体细胞中的病毒基因组,研究团队又开发了自动感应和降解病毒基因组的ALICECas9系统(图3)。实验结果显示,该系统中Cas9蛋白只有在病毒存在的情况下才会表达,因此形成闭环式基因线路,成功避免了Cas9蛋白持续性表达引起的细胞消耗、脱靶、耐药毒株等诸多安全性问题。同时,研究团队通过串联多重sgRNA,成功实现了腺病毒(ADV)和HSV-1的多病毒同时清除。已有研究显示,CRISPR基因编辑技术在短时间内抑制病毒复制,将会促使病毒处于潜伏状态;一旦核酸酶耗尽,极易造成病毒再度复发。因此,ALICECas9系统成功实现了感应病毒的核酸酶自动输出,将进一步推动CRISPR基因编辑技术在抗病毒领域中的应用。

图2 ALICECas9系统。
4. 设计构建自动感应和的抑制病毒的ALICEAb系统
中和抗体具有良好的病毒抑制效果,但是生产成本高、制备周期长。研究团队开发了自动感应和抑制病毒的ALICEAb系统,成功组装了低成本、调控表达、具有抗病毒功能的中和抗体细胞药物工厂。
5. 设计构建自动感应双重输出抗病毒的ALICECas9+Ab系统
在上述的研究基础上,研究团队建立了响应强度和抑制能力更强大的ALICECas9+Ab系统(图3),从病毒入侵和复制两个角度出发,协同发挥抗病毒效果。研究团队将ALICECas9+Ab基因线路上载至底盘细胞HEK-293T的基因组中,成功筛选出一株抗病毒效果最佳的细胞株HEKALICE-Cas9-E317Ab。实验结果显示,HEKALICE-Cas9-E317Ab细胞株,具有和高浓度抗HSV-1药物阿昔洛韦(ACV)相当的病毒抑制效果,可避免ACV长期使用引发耐药毒株的出现。
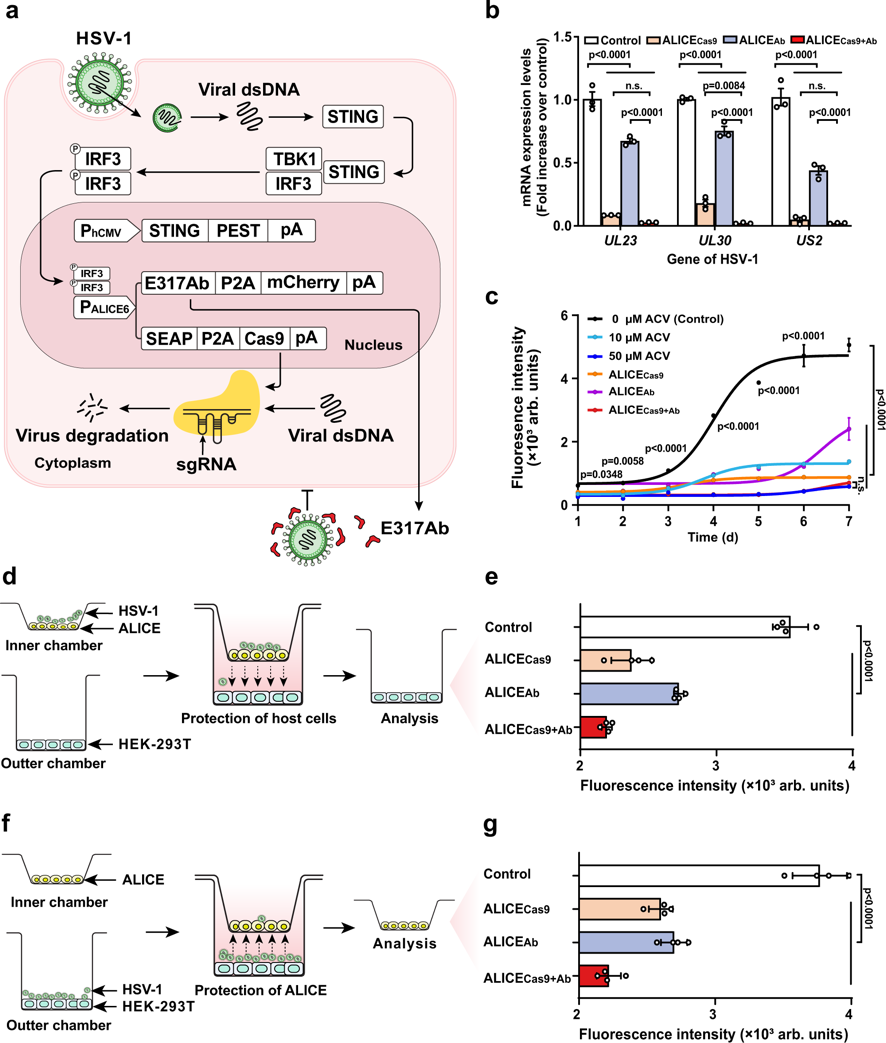
图3 ALICECas9+Ab系统。
6. 动物模型体内测试ALICE系统的抗病毒效果
随后,研究团队将ALICE系统上载至底盘细胞中,并由水凝胶包裹移植到小鼠体内。实验结果显示:无论在病毒感染发生的前、中、后期,ALICE系统均能自动感知和抑制病毒。尤其令人兴奋的是,ALICE系统携带的中和抗体输出模块,可在病毒感染后的六小时自动输出,比人体适应性免疫系统产生中和抗体至少提早了一周。为了进一步探索ALICE系统的临床应用前景,研究团队选取由单纯疱疹病毒1型(HSV-1)感染引发的疱疹性角膜炎(HSK)小鼠模型,由腺相关病毒(AAV)载体递送ALICE系统至小鼠的眼角膜。实验结果显示:ALICE系统能够成功抑制小鼠角膜、三叉神经节以及大脑中的病毒载量;并且面对病毒的迭代感染,也能发挥良好的抗病毒效果。目前,临床上治疗HSV-1的常用方法是抗病毒药物,如阿昔洛韦(ACV)等核苷类似物,这类药物靶点单一,极易造成耐药毒株的出现。ALICE系统的出现无疑是给抗病毒治疗领域,提供了一种灵活、创新、模块化的抗病毒治疗新策略。总而言之,模块化设计的闭环式ALICE系统,拥有可更换的检测模块、灵活布线的内源信号网络、多重的输出模块,经由不同的底盘细胞或AAV载体递送,能够灵活应用于特定的病原体防控需求(选择合适的控制元件)。ALICE技术平台作为人造抗病毒免疫系统,可诱导干扰素表达释放发挥非特异性抗病毒免疫功能,或诱导中和抗体等发挥适应性免疫防御,增强机体的免疫防御体系。研究团队认为,本研究中的各类ALICE系统可作为示例模型,未来很容易适应特定免疫样细胞的设计开发,实现以哺乳动物为目标的潜在病原体的智能感应和清除。据悉,华东师范大学叶海峰研究员和杜克-新加坡国立大学医学院王林发院士为该研究论文的共同通讯作者,华东师范大学博士后王义丹为该研究论文的第一作者。原文链接:https://www.nature.com/articles/s41467-022-35425-9
来源:BioArtMED





