一种细菌载体药物递送系统

在生命科学和疾病治疗的研究领域,能够将特定蛋白质输送到特定细胞,是科学家梦寐以求想要拥有的能力。然而,这其中面临重重困难,无论是瞄准目标细胞,还是跨细胞膜运输所需的蛋白质,都是极具挑战的艰难任务。
在很多时候,自然是我们最好的老师,许多天然系统的巧妙程度超乎想象。近日,麦戈文脑科学研究所及布罗德研究所的研究人员,就在张锋教授的带领下,利用一种天然的细菌系统,在人工智能AlphaFold的帮助下,开发了蛋白质运输的新方法。
这项发表在《自然》杂志上的新技术,使用的是一种由细菌产生的类似“注射器”的微型结构,可以通过编程将一系列有用的蛋白质输送进不同类型的细胞之中。
透射电子显微术呈现的细菌注射系统。(图/Joseph Kreitz/Broad Institute, McGovern Institute)
研究人员已经证实,这种方法在人类细胞和动物中都能发挥作用,有望成为传递基因疗法和癌症疗法的一种安全且高效的方式。
通过收缩进行注射
对于内共生细菌来说,分泌一些有助于共生适合度的因子,通常是有利的。然而,许多这类因子并不能轻易通过细胞膜,这就导致内共生细菌进化出了一套复杂的能主动将有效蛋白质输送到目标细胞的系统。
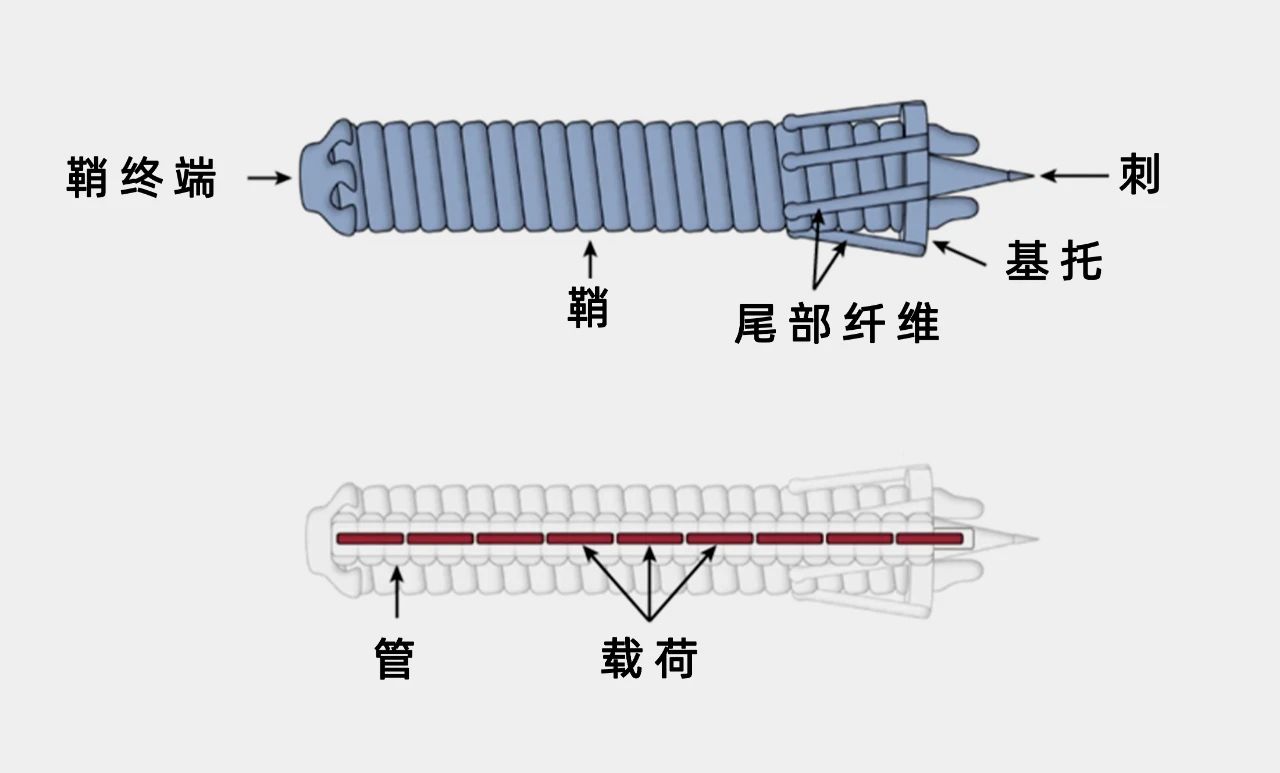
细胞外收缩注射系统(eCIS)的结构示意图。图中所示的是一个发光杆菌毒力基因簇(PVC)的例子,它是由发光杆菌产生的eCIS。(图/Kreitz, J. et al., Nature)
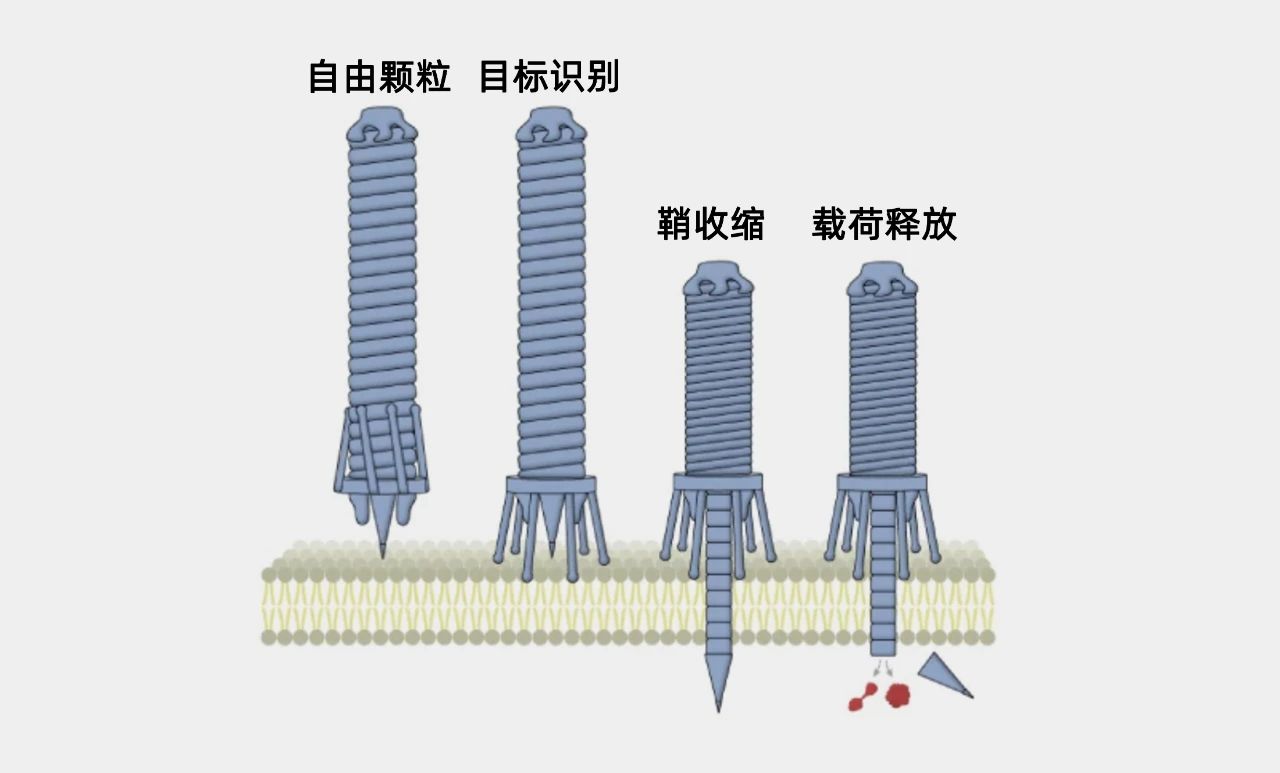
细胞外收缩注射系统(eCIS)就是这样一个例子。它们是一类约100纳米长的有着注射器形状的大分子化合物,由一个鞘状结构内的刚性管组成,这个鞘会收缩,驱动管末端的一个尖刺穿过细胞膜。利用eCIS,内功生细菌可以像“打针”那样,将管内的蛋白质注入细胞,进而达到帮助调整周围的生物环境、提高生存能力的目的。
近年的一些研究表明,eCIS可以天然地靶向小鼠细胞,但并不清楚它们能否在人类细胞中发挥作用。此外,这些系统识别靶细胞的机制,目前也尚不明确。
eCIS一端的外侧是尾部纤维,它能识别细胞表面的特定受体,并将它锁住。因此,研究人员认为,通过重新设计这处尾部纤维,使其与不同的受体结合,也许就可以修改整个系统,从而将蛋白质输送到人类细胞中。
研究人员设计的由PVC介导的蛋白传递机制,PVC可能通过尾部纤维识别目标细胞,导致鞘状机制收缩,从而推动尖刺穿过细胞膜。然后,蛋白质通过管复合物的分解进入细胞。(图/Kreitz, J. et al., Nature)
他们想到了强大的人工智能AlphaFold,它能根据氨基酸序列预测蛋白质的结构。利用AlphaFold,研究人员重新设计了由发光杆菌属(Photorhabdus)的细菌产生的eCIS的尾部纤维,使其可以与人类细胞结合。通过重新设计eCIS的另一个部分,科学家诱使注射器输送了他们所选的蛋白质,在某些情况下,效率非常之高。
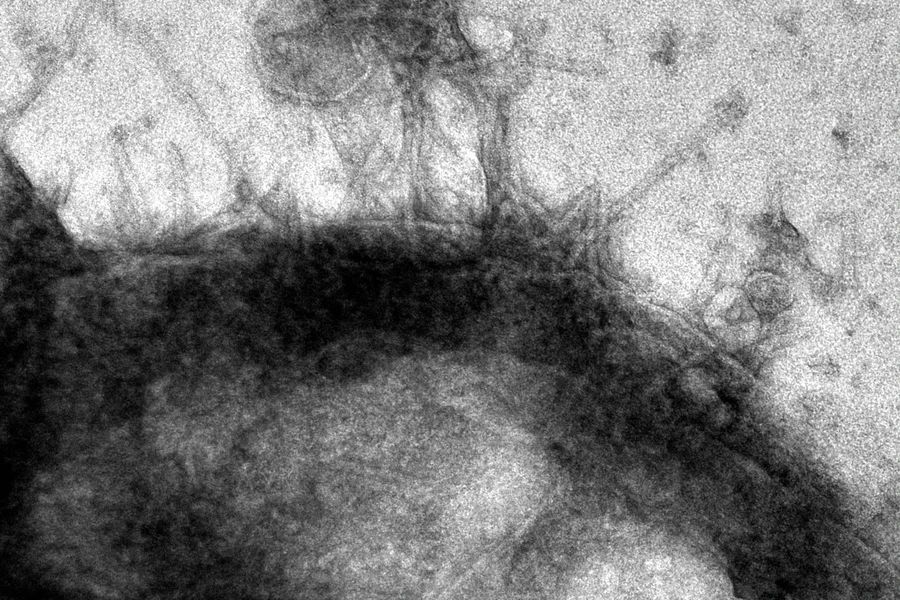
通过透射电子显微镜成像,与癌细胞结合的PVC。(图/Joseph Kreitz/Broad Institute, McGovern Institute)
团队创造了专门针对表达表皮生长因子(EGF)受体的癌细胞的eCIS,结果表明,它们几乎100%地杀死了这些细胞,但并没有影响那些没有受体的细胞。尽管效率部分取决于系统设计的目标受体,但这些发现证明了这个系统在详细的工程设计下的前景。
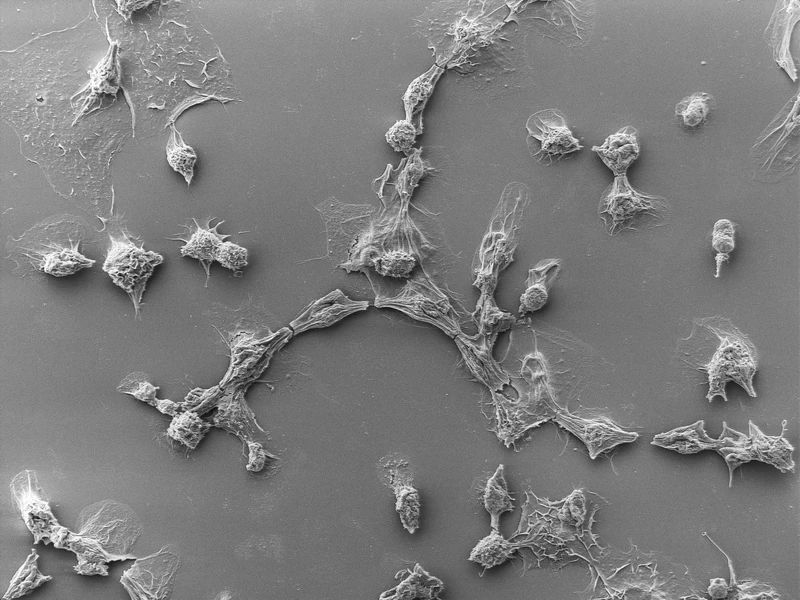
被PVC杀死的癌细胞。(图/Joseph Kreitz/Broad Institute, McGovern Institute)
研究人员还使用eCIS向活体小鼠的脑部输送了蛋白质,发现它并没有诱发小鼠出现可检测到的免疫反应。这表明eCIS有朝一日有望被用来安全地向人体输送基因疗法。
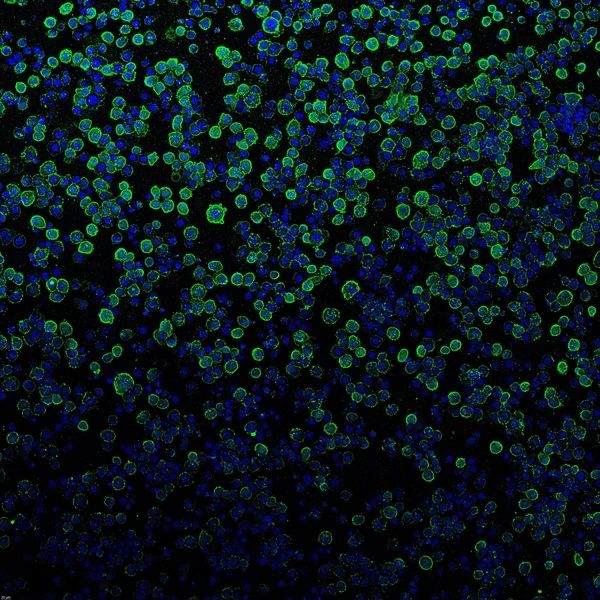
在注射有效载荷蛋白前,PVC(绿色)与昆虫细胞(蓝色)结合。(图/Joseph Kreitz/Broad Institute, McGovern Institute)
包装蛋白质
eCIS系统是多功能的,团队已经用它来输送了一系列“货物”,包括碱基编辑蛋白(可以对DNA进行单字母改变)、对癌细胞有毒的蛋白,以及Cas9,也就是一种用于许多基因编辑系统的大型DNA切割酶。
未来,研究人员还可以设计eCIS系统的其他组件,以调整其他属性,或传递其他货物,如DNA或RNA。这种类型的系统在生物学中发挥着真正重要的作用,这些作用还有待探索。
研究人员还想更好地了解这类系统在自然界中的功能。他们相信,这是说明蛋白质工程可以改变一个天然系统的生物活性的绝佳示例。它证实了蛋白质工程是生物工程和开发新治疗系统的一种有用工具。目前,治疗分子给药是医学的一个主要瓶颈。人们需要借助这些强大的新疗法进入身体的正确细胞。通过学习自然界如何运输蛋白质,或许能帮助解决这一差距。
#创作团队:
编译:Takeko
排版:雯雯
#参考来源:
https://news.mit.edu/2023/bacterial-injection-system-delivers-proteins-mice-human-cells-0329
https://www.nature.com/articles/s41586-023-05870-7
https://www.nature.com/articles/d41586-023-00922-4
#图片来源:
封面图&首图:Joseph Kreitz, Broad Institute, McGovern Institute
来源:原理 2023-04-03





