癌细胞爱吹泡泡,生存还是死亡?
调节细胞死亡的生物学过程可以及时清除体内的癌变细胞。然而,某些细胞有办法阻碍这一过程。近日,Weems 等人揭示了其中一种对抗死亡的机制,即依赖于被称为胞泡(Bleb)的细胞突出物。
多年以来,人们普遍认为细胞表面的泡状突起预示着细胞正在走向死亡,因为凋亡的典型特征就是细胞表面会产生大量的凋亡小泡。然而,有人很早就观察到,某些细胞在应激条件下虽然会吐泡泡,但并不走向死亡而是继续存活下去,但人们对这一现象背后的生物学机制并不清楚。此后,研究人员还发现,细胞的泡状突起对细胞的迁移、分裂等过程中发挥着重要作用。
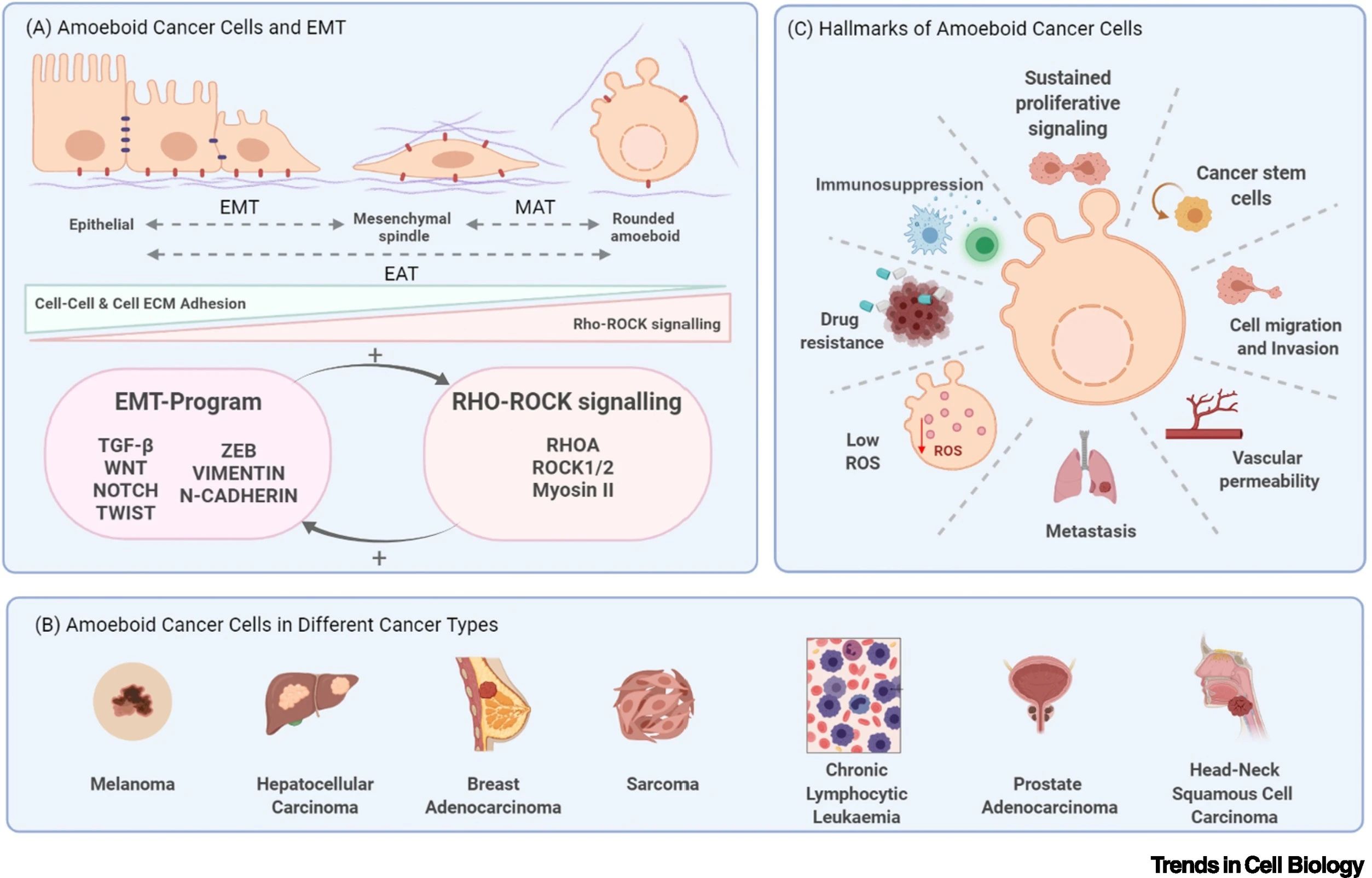
▲ 10.1016/j.tcb.2021.10.004
在 Weems 及其同事的研究系统中,细胞死亡是因为细胞失去对周围组织的附着而引起的,这一过程被称为失巢凋亡(anoikis)。因此,尽管某些类型的细胞,如血细胞,可以在与周围环境没有强而稳定的粘附的情况下存活并发挥其功能,但脱离附着组织的细胞通常会发生失巢凋亡。细胞的受控死亡需要激活诱导细胞内的相关信号通路,但某些细胞可以通过激活促进生存的相反信号来逃避这一过程。
本应通过失巢凋亡而被清除的细胞如果存活下来,通常预示着不良的临床后果,比如癌细胞的扩散和转移。因此,确定脱离后细胞存活与死亡之间的平衡控制机制,将有助于理解正常生理事件的进展和实现,也可能有助于揭示一些疾病的基础并提供新的干预靶点。
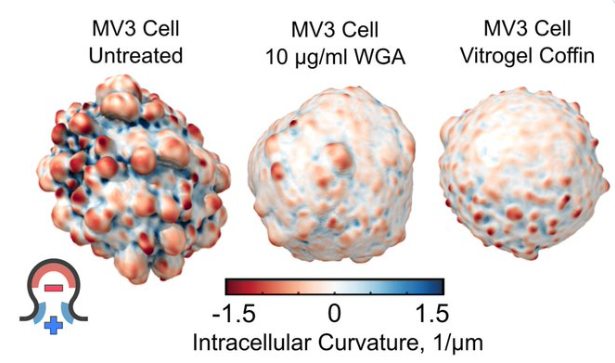
在低粘附条件下,迁移和侵入组织的细胞通常会形成胞泡 (Bleb,图1),这是由静态压力驱动的球形细胞突出物。在肿瘤形成和转移的过程中,胞泡的存在与肿瘤侵袭性和促生存通路的激活相关。有趣的是,黑色素瘤的转移细胞在脱离组织后常常会形成胞泡,但与大多数非恶性细胞不同的是,它们不会发生失巢凋亡(anoikis)。这些观察促使Weems 和同事们去探索黑色素瘤细胞在没有粘连的情况下逃避死亡的机制,重点是胞泡在这一过程中可能发挥的作用。
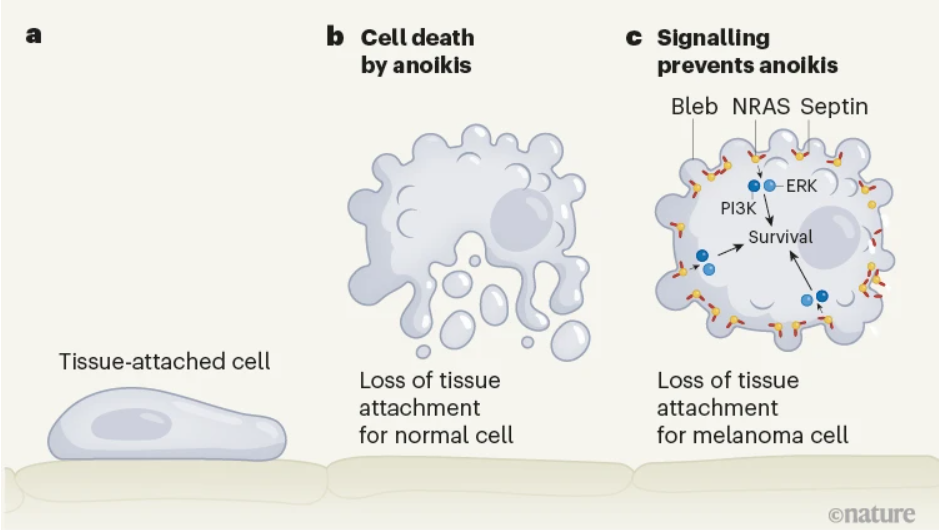
▲ 图1 | 逃避细胞死亡的系统。a、体内的大多数细胞都需要附着到组织上。b、当正常细胞与周围组织分离时,它们会经历一个细胞死亡的过程——失巢凋亡。c,癌细胞可以逃避失巢凋亡,Weems 等人报道了皮肤癌黑色素瘤逃避失巢凋亡的一种机制。分离的细胞形成突起,称为胞泡(Bleb)。作者报告说,胞泡的“颈部”是膜弯曲的位置,提供了一个可以组装致癌信号轴的位置。这个信号轴的关键蛋白质包含 NRAS 和 Septin,进而触发由蛋白质 PI3K 和 ERK 介导的促进癌细胞生存的信号级联。
作者表明,抑制胞泡的形成意味着黑素瘤细胞失去了逃避失巢凋亡的能力。有趣的是,在促进胞泡生长的条件下,研究人员发现了位于胞泡“颈部” (泡与细胞表面其余胞膜之间的边界) 的 Septin 蛋白。与 Septin 的定位线索来自于胞泡诱导的膜曲率相一致的是,Weems 等人证明干扰胞泡形成或 Septin 感知膜曲率的能力,均会大大减少定位于胞泡中的 Septin。
作者通过抑制泡的形成来检测胞泡依赖的 Septin 定位与细胞死亡的相关性。作者发现,这种干扰会导致脱离基质的黑色素瘤细胞的死亡,而未被干扰的癌细胞可在脱离基质后存活。
通过探索规避失巢凋亡 (亦即失巢凋亡抵抗) 的分子机制,作者确定了与 Septin 相互作用的蛋白质。作者发现并深入探究了一种突变形式的 NRAS 蛋白,这是一种控制细胞分裂和生存信号通路的蛋白质。
事实上,Weems等人发现,突变的 NRAS 位于细胞中 Septin 所在的位置,这种共定位依赖于 NRAS 与 Septin 的相互作用和胞泡活动。十分重要的是,抑制 NRAS 功能会干扰黑素瘤细胞逃避失巢凋亡的能力,这一结果促使作者研究可能在 NRAS 下游起作用的信号级联的作用。这反过来又确定了依赖于 ERK 和 PI3K 的细胞信号途径。这两个信号通路可以促进细胞的存活。作者观察到,PI3K 在 Septin 和 NRAS 共同存在的位点上被激活。基于这些发现,Weems 等人认为,胞泡边缘的膜曲率是促生存信号轴心成核的位置,这些信号轴心有助于抵消失巢黑色素瘤细胞的死亡倾向。
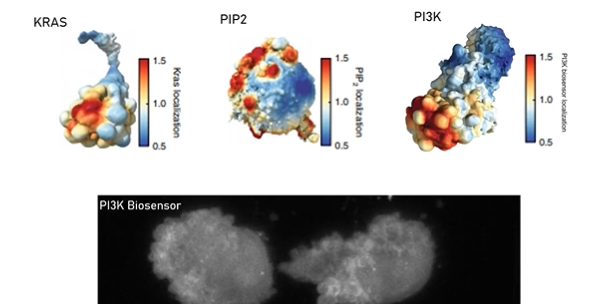
重要的是,促进肿瘤形成的信号级联并不是癌细胞所特有的,也被正常细胞用于激活或抑制其信号通路。Weems 等人的研究结果表明,在非恶性细胞中也存在由胞泡控制的失巢凋亡逃逸的分子机制。具体来说,作者发现增强胞泡或隔膜活性可以使非肿瘤细胞类型 (如正常的成纤维细胞) 有能力逃避失巢凋亡。
Weems 和同事的研究结果对理解黑色素瘤以外的疾病有广泛的意义。这些发现也为研究各种生理过程提供了一个新的起点。他们的研究还说明,人们需要建立合适的显微镜、图像处理方法和分析工具来研究这种类型的细胞现象。
虽然失巢凋亡抵抗主要发生在癌细胞中,但在其他疾病中(如心血管疾病和糖尿病),也已有研究描述了调控不当的粘连控制的细胞死亡。在这些情况中,监测胞泡的形成和依赖于 Septin 的 NRAS-ERK-PI3K 信号轴参与的可能性,或许会为关注胞泡的形成和 Septin 功能的干预和治疗铺平新的道路。同样地,在正常发育和成人的生命过程中,许多迁移细胞类型都会形成胞泡,特别是在低粘连的条件下。因此,确定这些细胞 (如白细胞) 的存活是否受到类似 Weems 等人所揭示的机制的支持,将是很有趣的研究课题。此外,尽管在这种情况下,依赖于胞泡的信号轴组装可以干扰细胞的失巢凋亡,但在胞泡颈部组装信号分子还可能会激活与失巢凋亡无关的其他信号通路。作者在研究中使用了一系列的显微镜工具,并展示了 2019年报道的图像采集和分析工作流程的强大功能。Weems 等人的工作依赖于快速获取 3D高分辨率图像,再加上对细胞形状特征的无偏倚定量分析,对胞泡研究起到了十分重要的作用。在不同的实验条件下,确定特定蛋白质的亚细胞定位和蛋白质活性,将有助于作者提出的生物模型的制定化分析。在其他研究中使用这些方法,可能会帮助阐明许多其他涉及细胞形状和细胞-细胞相互作用的快速改变的动态过程。综上所述,Weems 等人发现了一种以前未知的细胞过程和生化信号级联,这种信号级联是细胞在与周围环境低粘附或无粘附的条件下存活所必需的。值得注意的是,Weems 等人的实验是在体外进行的,要最终证明作者所提出的模型对于恶性肿瘤确实是必要的,还需要对活组织和模式生物进行成像和分析研究。参考资料:1. https://doi.org/10.1038/d41586-023-00477-4
2. https://doi.org/10.1038/s41586-023-05758-6
说明:推文用于传播知识、普及科学,不构成任何医疗建议
来源:BioMedAdv 2023-03-05





