血小板与炎症性疾病损伤
免疫介导的炎症性疾病(Immune-mediated inflammatory diseases,IMIDs),如系统性红斑狼疮(SLE)、类风湿关节炎和银屑病在人群中流行率非常高(约占高收入国家人口3-8%),尽管治疗取得了进展,但仍然是世界范围内发病率和死亡的主要原因。IMIDs包括以自身抗体和自身反应性T细胞为特征的自身免疫性疾病,如系统性红斑狼疮或系统性硬化症,以及炎症性疾病,如银屑病或炎症性肠病。心血管并发症在炎症性疾病中多发,血小板活化被确定为导致血栓形成和心血管疾病风险增加的主要因素。血小板血小板是一种小的无核细胞(2-5µm),起源于巨核细胞(megakaryocytes)。它们是继红细胞之后最普遍的血液成分,在循环系统中巡逻,通过聚集来封闭损伤血管壁,达到止血目的。血小板含有几种颗粒。
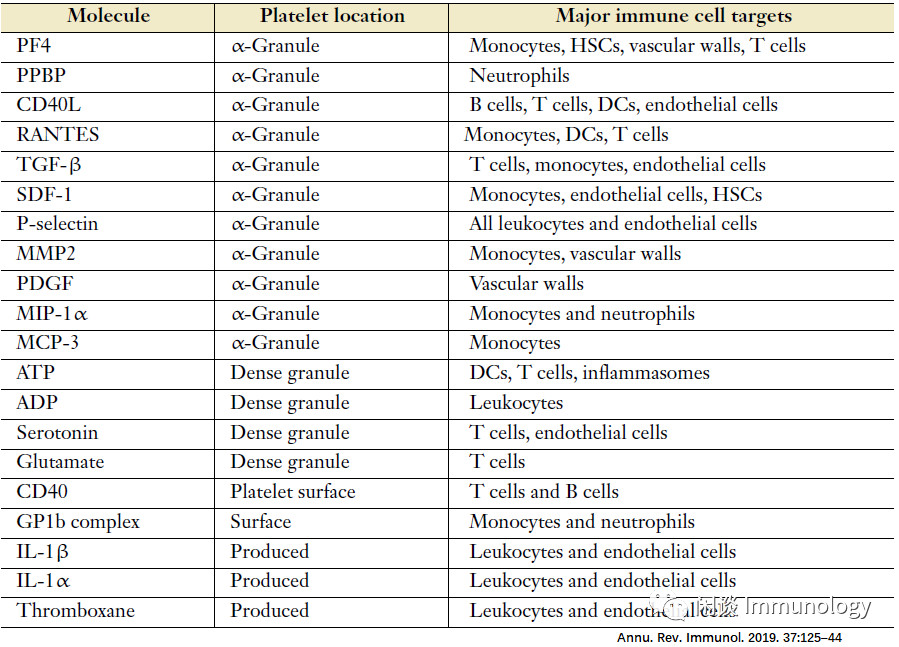
致密颗粒含有5-羟色胺、核苷酸(三磷酸腺苷(ATP)、二磷酸腺苷(ADP))和钙,以自分泌和旁分泌的方式增加血小板活化。α-颗粒中含有促进止血的分子,如血管性血友病因子和CXCL4(也称为血小板因子4),以及与血小板免疫功能相关的分子,如CD40配体(CD40L)、p-选择素(也称为CD62P)和补体等。血小板引起组织损伤通过与先天免疫细胞和适应性免疫细胞的相互作用,血小板影响其表型,促进炎症和自身免疫反应。血小板通过旁分泌-内分泌可溶性因子和配体-受体偶联的物理相互作用,介导的免疫细胞功能的调节。除了这些对免疫细胞的影响外,血小板还通过促进器官损伤来影响IMIDs的发病机制。
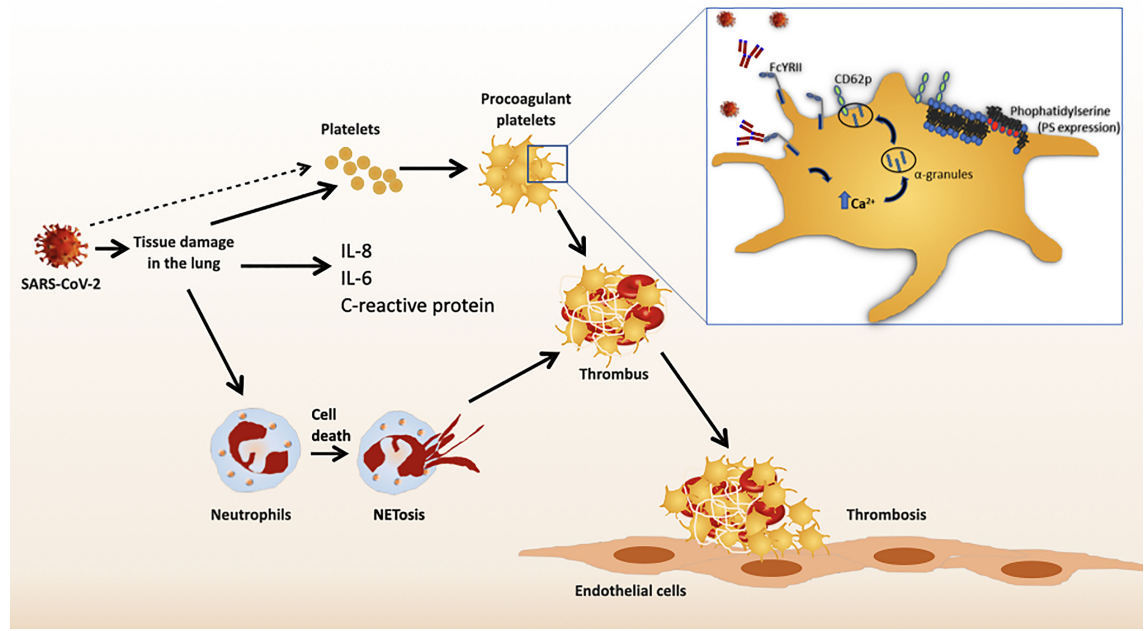
新冠免疫血栓形成Front. Immunol. 2022
组织损伤多发性硬化症是一种影响中枢神经系统(CNS)的自身免疫性疾病,可导致白质和灰质损伤,导致神经系统症状和残疾。在疾病发病前几天,血小板浸润中枢神经系统,早于T细胞。如果进行血小板消除,可以防止T细胞的侵袭和随后的中枢神经系统损伤。这些结果表明,血小板在炎症细胞归巢到中枢神经系统中发挥作用,从而促进免疫介导的中枢神经系统损伤。此外,血小板也可能通过FASL(也称为CD95L)和局部释放炎症细胞因子来促进中枢神经系统损伤。肾脏是几种IMIDs的靶器官,患者预后更差。活化血小板聚集可导致肾脏微循环中血栓,导致肾脏损害。这种微血栓广泛存在于系统性自身免疫性疾病中。溶血性-尿毒症综合征是一种以弥漫性微血栓引起严重肾损伤为特征的疾病,肠出血性大肠杆菌脂多糖介导的血小板活化导致组织损伤。值得注意的是,人类FCGR2A转基因在狼疮易发小鼠中的表达加速了血小板在肾脏中的积累,并导致更糟糕的病理损伤,这与血小板以FcγRIIA依赖的方式牢固粘附于肾脏沉积的免疫复合物的能力增加相一致。在抗肾小球基底膜(GBM)抗体介导的肾损伤模型中,血小板消耗导致肾小球p-选择素表达降低,中性粒细胞迁移减少,最终减少肾损伤。p-选择素缺陷小鼠在抗GBM注射后也表现出较温和的表型,通过输注野生型血小板,疾病进程加速(中性粒细胞迁移增加和局部ROS产生)。此外,CD40L+血小板刺激人肾小管细胞分泌IL-6,刺激足细胞产生基质金属蛋白酶9,分别促进炎症环境和组织瘢痕形成。血小板来源的CD40L也能刺激体外人系膜细胞局部产生CCL2(也称为MCP1),这可能通过增加免疫细胞浸润来促进组织损伤。最后,血小板源性生长因子和TGFβ都是由活化的血小板释放的,促进系膜细胞增殖和瘢痕形成,从而损害肾小球的完整性。组织纤维化血小板的活性与许多器官(如心脏、肾脏、肺和皮肤)的纤维化进展有关。血小板和血小板来源的细胞外囊泡是循环TGFβ的主要来源,循环TGFβ包含在它们的α-颗粒中,并在激活后被释放。人们普遍认为,TGFβ促进皮肤和肺纤维化通过诱导成纤维细胞增殖和促纤维化基因的上调等编码胶原、原纤维蛋白,在系统性红斑狼疮和系统性硬化症的发病机制中发挥作用。
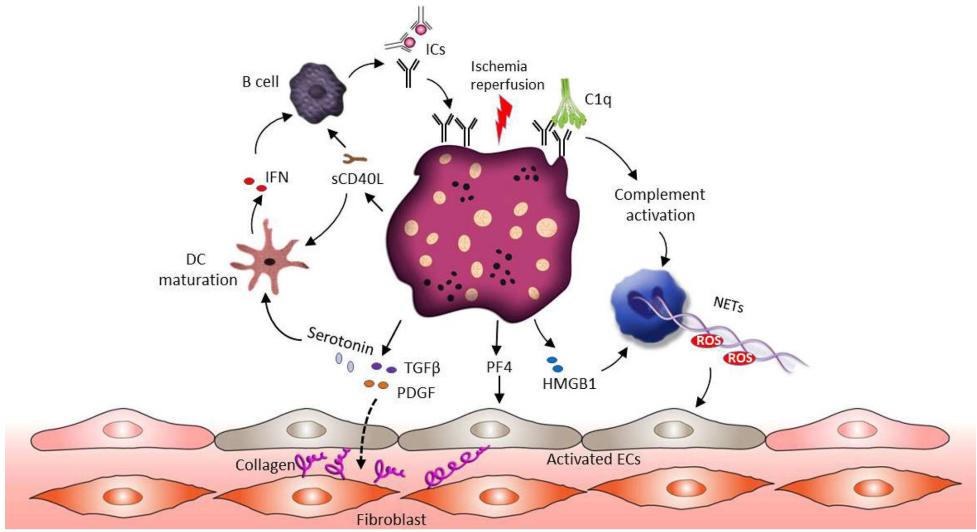
Front. Immunol 2019
其他血小板来源的分子,如胸腺基质淋巴生成素和血清素,与系统性硬化症中皮肤纤维化的进展有关。在实验模型中,血小板来源的β-血栓球蛋白和CXCL4与纤维化相关,并且在伴有肺纤维化的系统性硬化症患者的肺中发现它们的水平升高。然而,相互矛盾的数据表明,血小板可能需要通过刺激Treg细胞产生IL-10,将肺中的巨噬细胞重新编程为抗炎表型,从而导致炎症的解决和预防纤维化.
参考文献
Craig N. Morrell etc,The Platelet Napoleon Complex—Small Cells, but Big Immune Regulatory Functions,Annu. Rev. Immunol. 2019. 37:125–44Maouia, A., Rebetz, J., Kapur, R. & Semple, J. W. The immune nature of platelets revisited. Transfus. Med. Rev. 34, 209–220 (2020).Melki, I. et al. Platelets release mitochondrial antigens in systemic lupus erythematosus. Sci. Transl. Med. 13, eaav5928 (2021).Uzun G, Pelzl L, Singh A and Bakchoul T (2022) Immune-Mediated Platelet Activation in COVID-19 and Vaccine-Induced Immune Thrombotic Thrombocytopenia. Front. Immunol. 13:837629. doi: 10.3389/fimmu.2022.837629Liu X, Gorzelanny C and Schneider SW (2019) Platelets in Skin Autoimmune Diseases. Front. Immunol. 10:1453. doi: 10.3389/fimmu.2019.01453来源:闲谈 Immunology 2023-03-13




