免疫细胞为什么不攻击肠道微生物?
众所周知,免疫系统是一个由器官、细胞和蛋白质组成的复杂网络,在保护机体免受外来物质侵袭的同时,还要避免误伤自身组织和细胞。在正常情况下,免疫系统对数以万亿计的肠道微生物或外来无害抗原耐受,而不是去攻击它们。一旦这种耐受性被破坏,免疫细胞就开始不恰当地攻击肠道微生物,进而导致炎症性肠病(IBD)等慢性疾病。
然而到目前为止,科学家们对免疫系统“差别”对待的耐受机制仍知之甚少。北京时间9月8日,发表在《Nature》上的一项最新研究中,来自康奈尔大学威尔康奈尔医学院的研究团队发现一类先天淋巴细胞在建立对人类胃肠道中共生微生物的耐受性方面发挥重要作用。该研究为更好地治疗炎症性肠病、结肠癌和其他慢性疾病提供了关键线索。

在哺乳动物的胃肠道内,除了已定植的大量微生物组外,条件微生物或病原微生物也会随时“到访”。这些微生物引起的强大免疫反应通常由表达谱系特异性转录因子RORγt的免疫细胞主导。RORγt+细胞在肠道中协调免疫、炎症或耐受。此前的研究发现,在包括炎症性肠病、HIV感染和癌症等多种人类慢性疾病中,RORγt+免疫细胞的数量或功能发生了重大改变;但RORγt+免疫细胞间的细胞异质性、亚群间功能相互作用,以及在复杂的菌群环境中建立免疫耐受所必需的途径仍然未知。在这项新研究中,研究人员首先使用单细胞测序和荧光成像技术研究了健康小鼠肠系膜淋巴结(mLN)中表达RORγt的免疫细胞群。
他们发现,mLN中占主导地位的免疫细胞类型是调节性T细胞(Tregs)和淋巴组织诱导样3型天然淋巴细胞(LTi-like ILC3),这些细胞均存在于滤泡间区。ILC3是富集于哺乳动物肠道内的一类组织驻留先天淋巴细胞,是黏膜免疫的第一道防线。
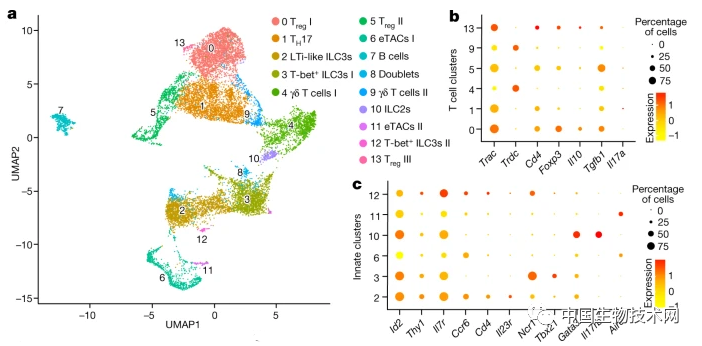
研究人员观察到,在滤泡间区的淋巴结区域,ILC3与RORγt+ 调节性T细胞 (Treg)密切相关,从而定义了一个新概念,即ILC3直接与Treg细胞相互作用以控制肠道的免疫耐受。
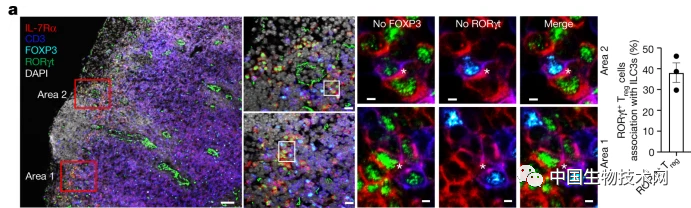
随后,他们通过实验证实了ILC3在促进肠道RORγt+ Treg细胞群中发挥的重要作用。就像对致病微生物产生免疫反应一样,ILC3呈递肠道微生物的片段,但这引发RORγt+Treg特异性识别这些细菌而不是炎症免疫反应,同时它们还会抑制其他T细胞反应,并增强对肠道微生物的耐受性。
当研究人员阻断ILC3用来呈递微生物抗原的表面分子MHCII以以阻碍ILC3与RORγt+Tregs的相互作用时,小鼠RORγt+Treg细胞数量显著减少,并自发发展为肠道炎症。同时,炎症性RORγt+T细胞,即辅助性T(Th)17细胞显著增加。部分原因是许多缺乏ILC3辅助细胞通常信号的Treg细胞转化为Th17细胞。
广泛的研究表明,ILC3是对肠道细菌免疫耐受必要且充分的强化因子。现在,这项新研究对ILC3用于与T细胞通信并驱动微生物组特异性Treg产生的信号有了更深入的了解。最后,为了确认与人类的潜在相关性,研究人员与儿科胃肠病学临床专家合作,分析了来自儿科炎症性肠病(IBD)患者或健康个体的肠道组织样本,并发现IBD患者ILC3细胞和RORγt+Treg细胞之间通信中断的证据。
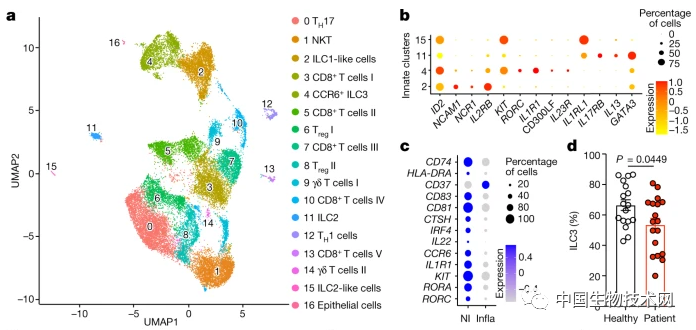
研究人员表示,这些发现为IBD患者免疫耐受性受损的潜在原因提供了解释,并有望带来新的疗法。目前,该团队正在试图确定ILC3-T细胞耐受机制如何区分共生微生物、有益微生物和致病微生物。到目前为止的结果表明,未来恢复ILC3功能的细胞疗法可能在抑制IBD炎症方面具有强大的作用。
论文链接:
https://www.nature.com/articles/s41586-022-05141-x
来源:中国生物技术网 2022-09-09





