为何1+1>2?CTLA-4/PD-1协同增强机制
众所周知,anti-PD-1联合anti-CTLA-4可以显著提高二者疗效,但因为治疗引起免疫相关副作用,限制了二者联合用药的广泛使用。
*CheckMate 067 Median OS (minimum follow-up, 6.5 years) was 72.1, 36.9, and 19.9 months in the combination, nivolumab, and ipilimumab groups
PD-1/CTLA-4双抗,希望实现1+1>2的效果,提升疗效,降低免疫相关副作用。康方生物的开坦尼(卡度尼利单抗注射液)拔得头筹,6月29日被附条件批准上市,用于治疗复发或转移性宫颈癌(R/M CC)。
CTLA-4+PD-1的协同效应
在今年5月份Nature Immunology发表综述,宾夕法尼亚大学佩雷尔曼医学院Alexander C. Huang和威尔·康奈尔大学医学科学研究院Roberta Zappasodi,系统阐述了CTLA-4抗体、PD-1抗体作用的细胞分子基础,有助于理解二者单药治疗、联合治疗、双抗临床疗效。
肿瘤微环境的免疫细胞CTLA-4和PD-1抗体发挥效应,主要依赖于肿瘤微环境中的T细胞。不同T细胞亚群有不同的功能,具体参考下面内容:
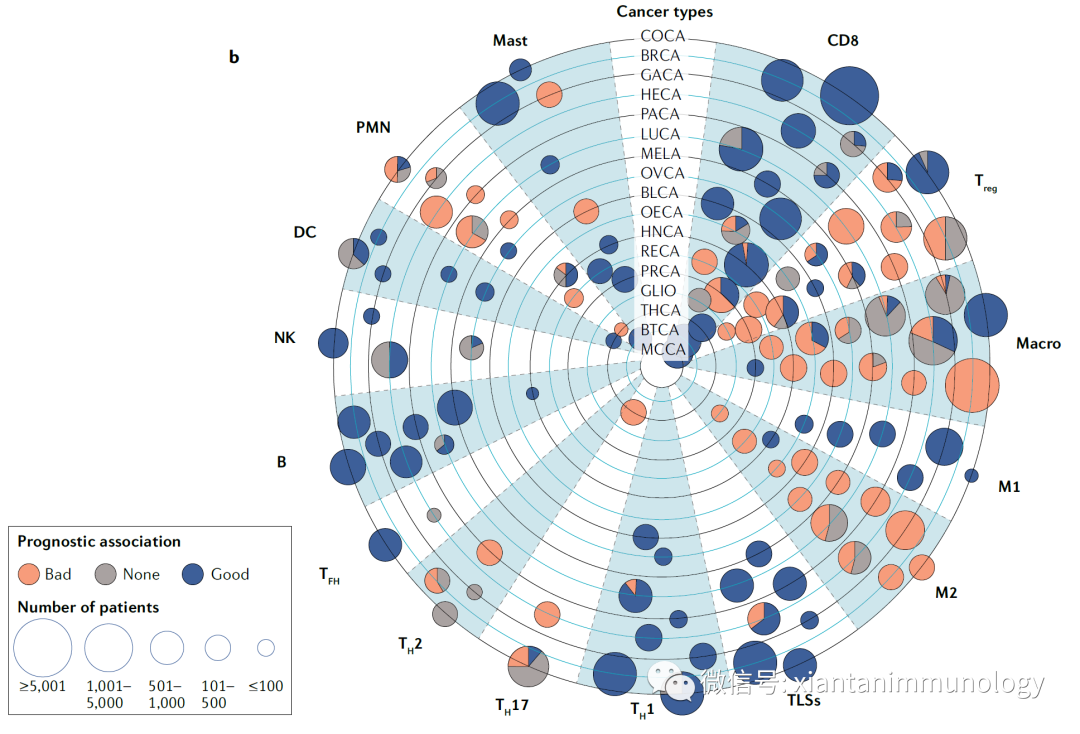
免疫细胞和肿瘤预后(Nat Rev Cancer . 2020.)
CD8+细胞毒性T细胞
在多种肿瘤(黑色素瘤、大部分鳞状细胞癌(SCCs)、大细胞肺癌和腺癌)浸润CD8+细胞毒性T细胞与较长的无病生存期(DFS)和/或整体生存率(OS)改善呈正相关。
T辅助细胞
CD4+T辅助细胞,有很多亚群(Th1/2/17/Treg/Tfh等),执行不同功能,因而可能对于肿瘤预后产生不同的影响。
Th1
Th1型CD4+T细胞及其分泌的细胞因子(IFN-γ)等与良好的肿瘤预后相关。但是也有例外,有报道th1与非小细胞肺癌(NSCLC)手术后2年生存率下降有关。
Th2
Th2细胞的存在与侵袭性肿瘤相关。例如,Th2型炎症与胰腺癌患者的生存率缩短有关,其中胰腺癌患者的肿瘤浸润性Th2细胞与原位成纤维细胞产生TSLP,调节髓样树突细胞(mDCs),TSLP诱导Th2细胞极化,进一步驱动Th2型炎症和胰腺癌不良预后。
Treg
FOXP3+ Treg与预后的关系,也因肿瘤而异。对于宫颈癌和肾癌,FOXP3+ Treg与不良预后密切相关,而在结直肠癌、膀胱癌、头颈部癌和血液系统恶性肿瘤,则呈正相关,对小细胞肺癌,胶质瘤,胶质母细胞瘤等无明显影响。
TFH
TFH细胞是一种特化的T辅助细胞,有助于生发中心的形成和维持,以及B细胞的成熟和获得免疫记忆。目前的共识是,肿瘤相关三级淋巴样结构(TLSs)中的TFH细胞-B细胞轴有利于塑造抗肿瘤的免疫环境。
CTLA-4和PD-1抗体作用免疫细胞差异
Alexander C. Huang和Roberta Zappasodi总结了已有的研究,用下面这张图比较清晰的阐述了二者的作用差异及协同机制的可能性。
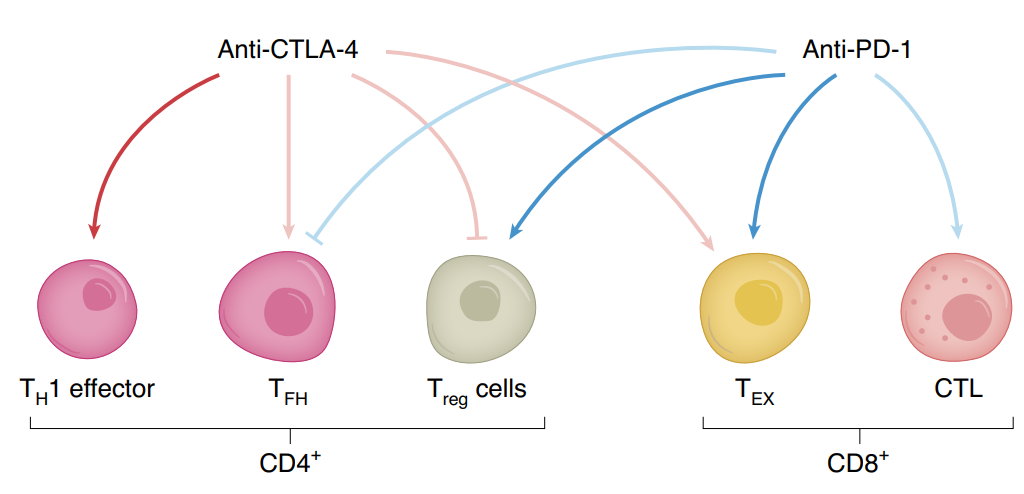
PD1抗体
- 主要活化的是耗竭T细胞(TEX)
- 次要活化细胞毒性T细胞(CTL)
- 也可活化抑制性的调节性T细胞(Treg)
- 抑制TFH活性
CTLA-4抗体
- 主要活化TH1细胞
- 次要活化TFH细胞和TEX
- 抑制Treg
这部分的数据主要来自于单药的结果,联合用药或者双抗,则会产生很多种可能性。
- 耗竭T细胞(Tex)的活化,PD-1和CTLA-4可能起到协同作用
- CTLA-4抗体同时活化了TH1效应细胞
- 对于抑制性Treg,CTLA-4抗体是否可以抵消PD-1抗体的活化作用?,如果可以,显然是非常理性的。
- 而CTLA-4抗体活化TFH的作用,是否会被PD-1抗体抵消掉?如果是,那么肿瘤局部三级淋巴结构的形成会受到影响,B细胞的抗肿瘤活性会被削弱。之前Nature有多篇文章报道了B细胞在免疫检查点治疗中的重要意义。(有效区分“应答患者”和“无应答患者”,B细胞在Immunoscore中的价值)
几个宫颈癌临床研究数据
Agenus Inc.的Balstilimab(PD-1单抗)和Zalifrelimab(CTLA-4)2期recurrent and/or metastatic cervical cancer临床研究数据。
Balstilimab单药:140可评估患者(无论PD-L1状态),15% ORR,3.6% CR,11.4% PR。PD-L1阳性:ORR 20%, PD-L1阴性:ORR 7.9%)

Gynecol Oncol.2021
联合用药(NCT03495882, J Clin Oncol . 2022):125位可评估患者(无论PD-L1状态),ORR 25.6%,8% CR,17.6% PR。PD-L1阳性患者,ORR 32.8%,PD-L1阴性:ORR 9.1%
卡度尼利单抗康方生物官方数据:100位可评估患者,无论PD-L1状态 ORR 33%,CR 12%,PD-L1阳性 ORR 43.8%。
从上述数据看,联合用药可将晚期宫颈癌的R/M宫颈癌的ORR从15%,提升至25.6%,康方生物的PD-1/CTLA-4双抗的ORR达到了33%,实现了1+1>2。
简评:不是结论,而是一种尝试。因为越来越多的免疫检查点,LAG3抗体、TIGIT抗体等,在临床开发时,是单药,联用PD-1还是CTLA-4,或是全新的两种免疫检查点联用,或是开发双抗。是否可以从其作用的不同T细胞亚群入手,预测是否可能存在协同作用?如果作用完全不相关,甚至相互抵消,那么可能联用和双抗就不是理想的策略...。
参考资料
- Pauken, K. E., Torchia, J. A., Chaudhri, A., Sharpe, A. H. & Freeman, G. J. Emerging concepts in PD-1 checkpoint biology. Semin. Immunol. 52, 101480 (2021)
- Wolchok, J. D. et al. Long-term outcomes with nivolumab plus ipilimumab or nivolumab alone versus ipilimumab in patients with advanced melanoma. J. Clin. Oncol. 40, 127–137 (2021)
- Phenotype, specifcity and avidity of antitumour CD8+ T cells in melanoma. Nature 596, 119–125 (2021).
- Eschweiler, S. et al. Intratumoral follicular regulatory T cells curtail anti-PD-1 treatment efcacy. Nat. Immunol. 22, 1052–1063 (2021).
- . Zappasodi, R. et al. CTLA-4 blockade drives loss of Treg stability in glycolysis-low tumours. Nature 591, 652–658 (2021).
- Alexander C Huang , Roberta Zappasodi,A decade of checkpoint blockade immunotherapy in melanoma: understanding the molecular basis for immune sensitivity and resistance,Nat Immunol . 2022 May;23(5):660-670.
- The immune contexture and Immunoscore in cancer prognosis and therapeutic efficacy,Nat Rev Cancer . 2020 Nov;20(11):662-680.
- David M O'Malley et al, Phase II study of the safety and efficacy of the anti-PD-1 antibody balstilimab in patients with recurrent and/or metastatic cervical cancer,Gynecol Oncol.2021 Nov;163(2):274-280.
- David M O'Malley et al, Dual PD-1 and CTLA-4 Checkpoint Blockade Using Balstilimab and Zalifrelimab Combination as Second-Line Treatment for Advanced Cervical Cancer: An Open-Label Phase II Study, J Clin Oncol . 2022 Mar 1;40(7):762-771.
来源:闲谈 Immunology 2022-07-06





