肿瘤相关高内皮静脉,被忽视的“主角”
2022年3月18日百时美施贵宝的LAG-3抗体Relatlimab获批,联合PD-1抗体Nivolumab治疗不可切除或转移性黑色素瘤。免疫治疗显然已经成为肿瘤临床治疗的主角,人们的视线也越加集中于免疫检查点表达的免疫细胞。
本文转载于:挑食的喵 闲谈 Immunology2022-03-25 08:29
肿瘤相关高内皮静脉
外周循环系统中CD8+T淋巴细胞流向肿瘤对于同流免疫治疗(ICB、疫苗或过继T细胞治疗)至关重要。在这一环节中,依赖于高内皮静脉(High endothelial venules,HEVs)。
HEVs表达高水平硫酸化的唾液酸粘蛋白,可以被淋巴细胞归巢受体(CD62L)和HEV特异性抗体MECA-79识别(用作免疫组化HEVs染色)。
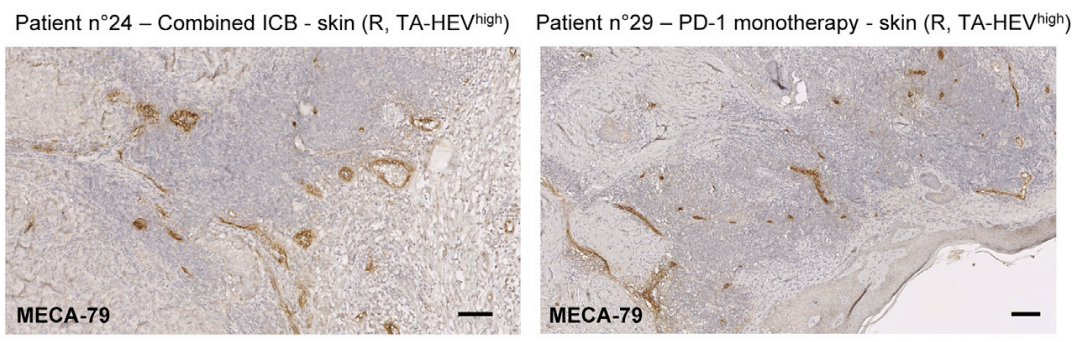
Cancer Cell 2022MECA-79+肿瘤相关高内皮静脉(Tumor-associated high endothelial venules,TA-HEVs)的密度与CD3+和CD8+T细胞和CD20+B细胞的密度相关,与原发性乳腺癌和黑色素瘤良好的临床预后相关。TA-HEV存在于三级淋巴样结构中,尤其是含有高密度T细胞和成熟树突状细胞的区域,非B细胞富含区域。
肿瘤相关高内皮静脉与肿瘤免疫治疗
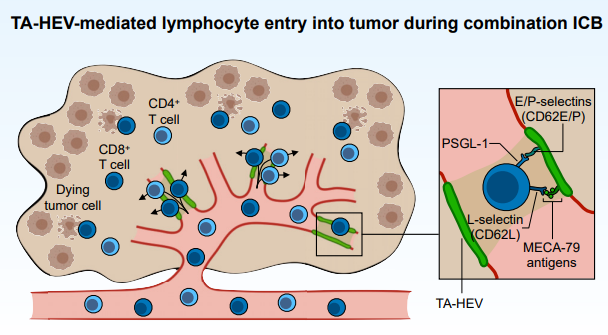
Cancer Cell 2022MECA-79+TA-HEV是癌症免疫和免疫治疗过程中,免疫细胞滚动、黏附(依赖CD62L)、外渗到肿瘤局部的主要位点。
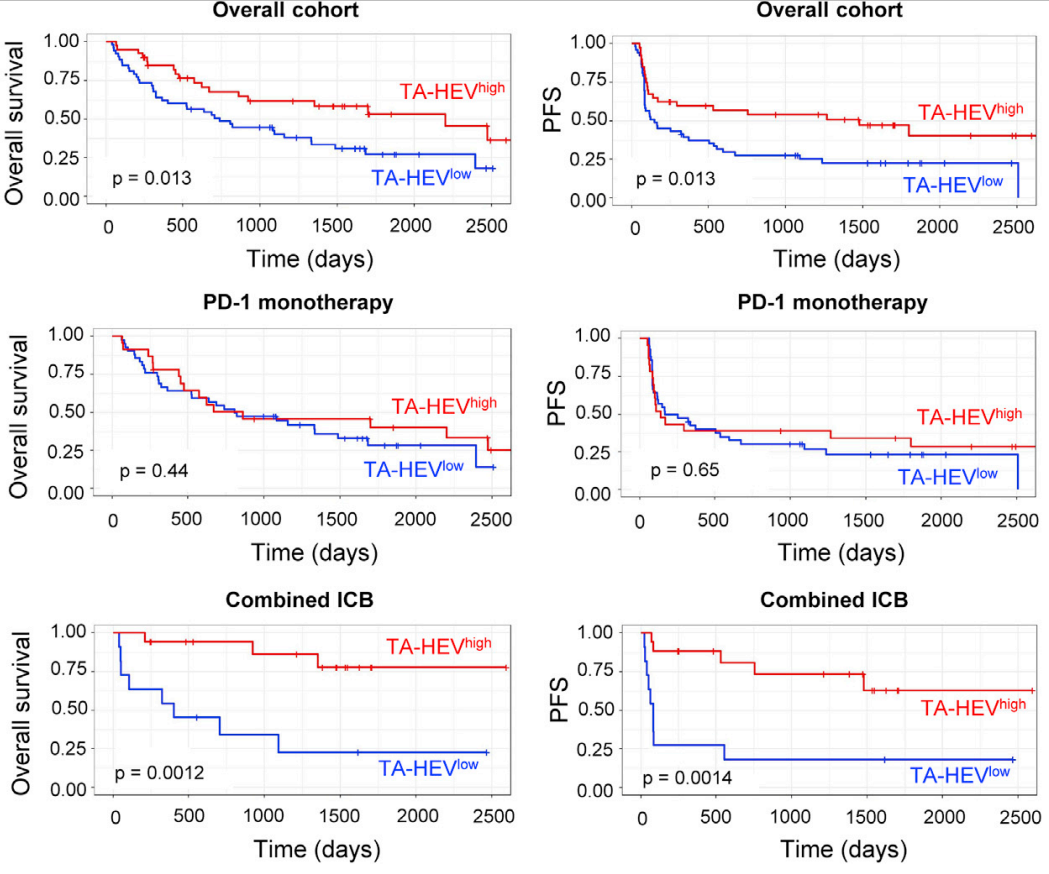
在发生免疫逃逸的肿瘤,TA-HEVs的密度低,而免疫检查点阻断治疗(immune checkpoint blockade,ICB)可以增加肿瘤微环境中TA-HEVs的密度,进而增加肿瘤浸润性CD4+和CD8+T细胞的丰度。免疫检查点阻断剂联合治疗比单药可以更加明显的增加TA-HEV密度,以及CD4+和CD8+T细胞的丰度。
临床疗效上(NCT02857569),PD-1单抗单药治疗时,TA-HEVshigh病人 OS和PFS有轻微改善(OS, p = 0.44; PFS, p = 0.65);但是在和CTLA-4单抗联用时,TA-HEVshigh病人OS和PFS有非常显著的改善(OS, p = 0.0012; PFS, p = 0.0014)。
Cancer Cell 2022
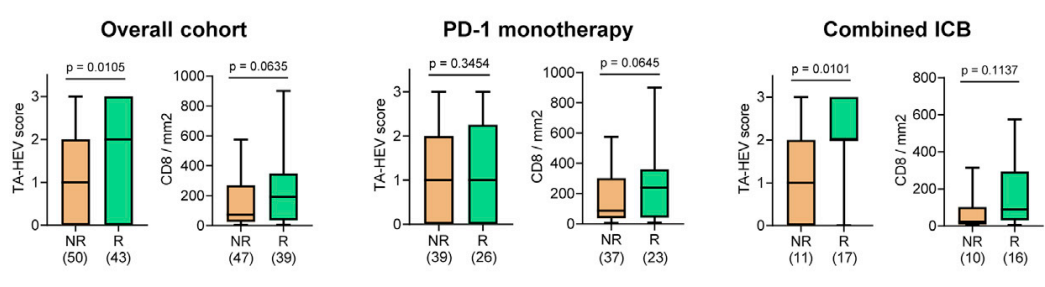
TA-HEV作为ICB联合治疗的预测标志物
Cancer Cell 2022
联合治疗时,使用TA-HEV评分,可以显著的区分应答患者和非应答患者(p=0.0101),其价值高于浸润的CD8+T细胞。但是对于PD-1单药治疗,TA-HEV并没有体现出明显的预测价值(p=0.3454)。
简评:免疫检查点抑制剂主要作用于免疫细胞,因而免疫细胞进入肿瘤微环境是关键。肿瘤相关高内皮静脉作为免疫细胞(尤其CD8+T细胞)进入肿瘤微环境的通道,其密度与治疗(尤其是联合治疗)效果相关,可作为联合治疗的预测标志物。
参考文献
- Sharma, P., Siddiqui, B.A., Anandhan, S., Yadav, S.S., Subudhi, S.K., Gao, J., Goswami, S., and Allison, J.P. (2021). The next decade of immune checkpoint therapy. Cancer Discov. 11, 838–857.
- Oliveira, G., Stromhaug, K., Klaeger, S., Kula, T., Frederick, D.T., Le, P.M., Forman, J., Huang, T., Li, S., Zhang, W., et al. (2021). Phenotype, specificity and avidity of antitumour CD8(+) T cells in melanoma. Nature 596, 119–125.
- Assia Asrir et al, Tumor-associated high endothelial venules mediate lymphocyte entry into tumors and predict response to PD-1 plus CTLA-4 combination immunotherapy. Cancer Cell 40, 318–334, March 14, 2022





