抗感染免疫,女性强于男性!
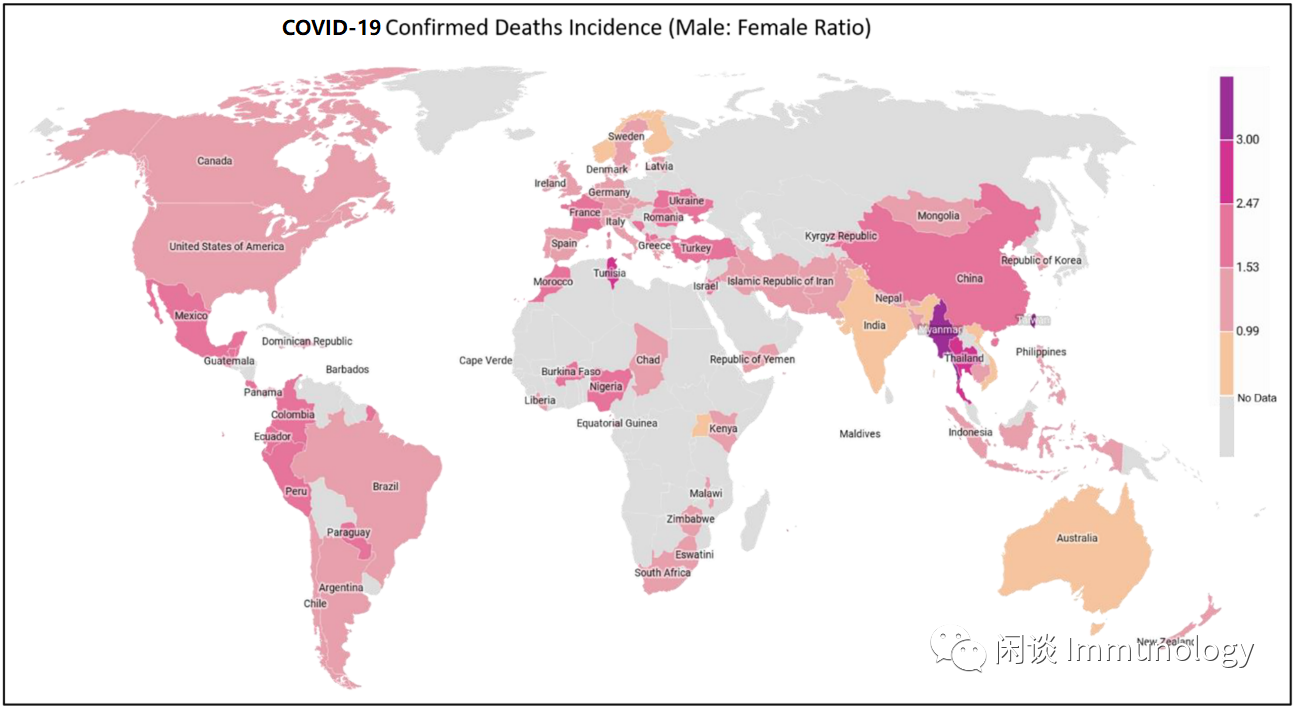
Global heath 5050 对于全球COVID-19确诊病例,ICU重症患者以及死亡病例进行统计,发现女性患者从确诊比率,到重症和死亡的比率都明显低于男性(数据链接见参考资料1)。显然,女性的雌激素促进了抗感染免疫,降低重症患者的炎症,减少心肺损伤,展现更好的预后。
本文转自:挑食的喵闲谈 Immunology2022-03-08 08:11
雌激素是重要的免疫激活剂
雌激素结合雌激素受体α(ERa)控制生理功能,包括激活免疫系统。
- 促进巨噬细胞、DC等APC活化和抗原递呈(呈剂量依赖)
- 激活NK细胞(呈剂量依赖)
- 雌激素促进鼻粘液的分泌。鼻粘液含有抗病毒、抗菌的相关因子,如IgA、黏液酶、乳铁蛋白、电解质和低聚糖等,限制上呼吸道感染
- 促进透明质酸的合成,从而保持纤毛和粘膜的正常功能
- 激活TLR信号通路(尤其是TLR3、TLR7、TLR9)
- 促进Th1、Th2细胞反应
- 促进T淋巴细胞的活化和增殖
- 促进Th1释放IFN-γ
与雌激素相反,睾酮对免疫反应有抑制作用:
- 抑制树突状细胞的活化、抗原呈递和免疫应答启动
- 可以通过抑制Th1的增殖
- 减少IFN-γ的合成
- 抑制Th2细胞反应
雌激素抗炎活性及心肺功能保护作用
雌激素可以降低炎症因子水平
烈性呼吸道传染病,如SARS,MERS,H7N9、H5N1、SARS-CoV-2等感染引起重症呼吸道症状,与细胞因子/趋化因子(IL-6、IL-2、IL-8、IL-7、CCL2、CCL3和TNF)水平升高,导致组织损伤和随后的器官衰竭相关。
COVID-19流行中,大多数女性在感染的初始阶段产生了抗刺突蛋白的IgG,有助于抑制促炎细胞因子。雌二醇可以降低IL-6、IL-8等炎症因子水平,降低COVID-19的严重程度。
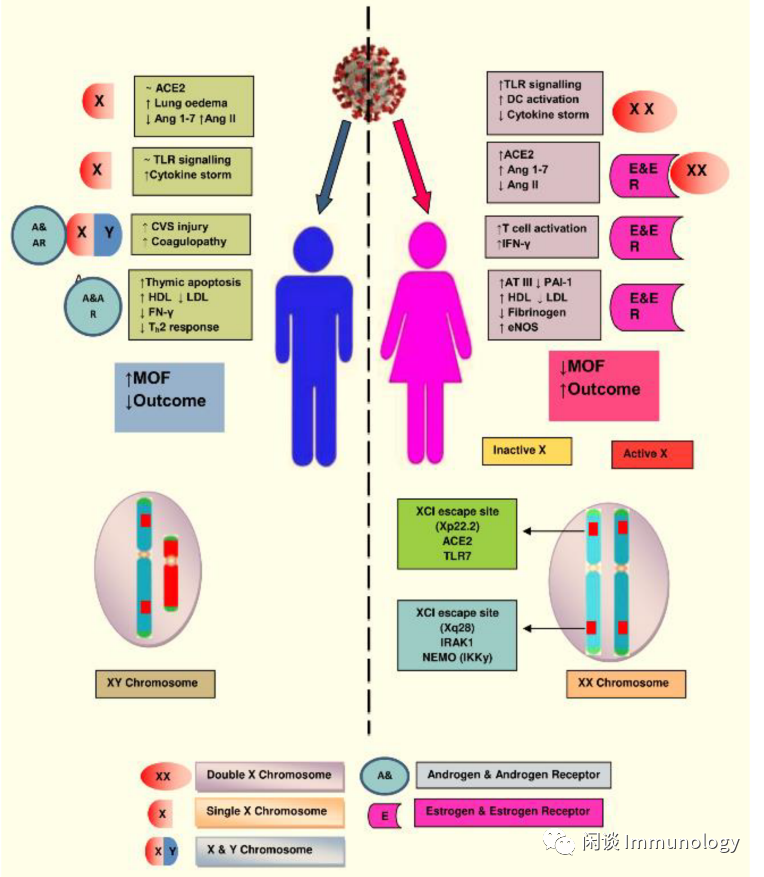
ACE2-血管紧张素系统
在女性,为了减少X-连锁基因的复制,第二条X染色体通过X染色体失活(XCI)而被沉默。ACE2基因在染色体Xp22.2上,通过绕过X失活,导致了性别之间的表达差异(男性表达1个ACE2,而女性表达2个ACE2)。
SARS-CoV-2通过16个受体结合基序(RBM)残基,与ACE2 20个结合残基中的16个结合,从而进入细胞内。女性两条X染色体表达两个ACE2,一个结合SARS-CoV-2, 另外一个ACE2分解AngII为Ang1-7。
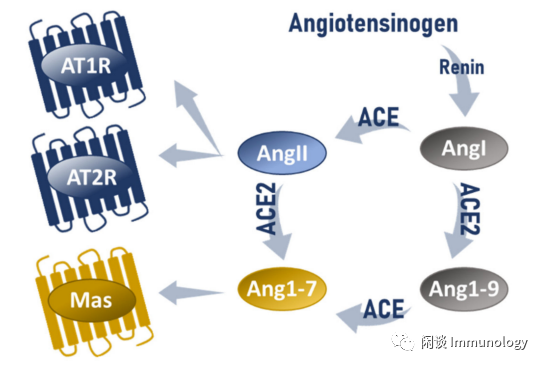
Int. J. Mol. Sci. 2021, 22, 12800
在肾素-血管紧张素系统(renin-angiotensin system,RAS)中,Ang1-7结合受体Mas,通过PI3k-Akt等途径,舒张血管,降低血压,抑制心肌增殖肥厚。同时,抑制Nf-κB转录激活,抑制炎症因子(TNF-α、IL-6等)表达,也是拮抗炎症的机制之一。
而Ang II紧张血管作用相反,结合AT1R,通过PLC-PKC-MAPK-ERK通路,升高血压,促进心肌增殖肥厚,同时增加ROS释放,促进炎症。
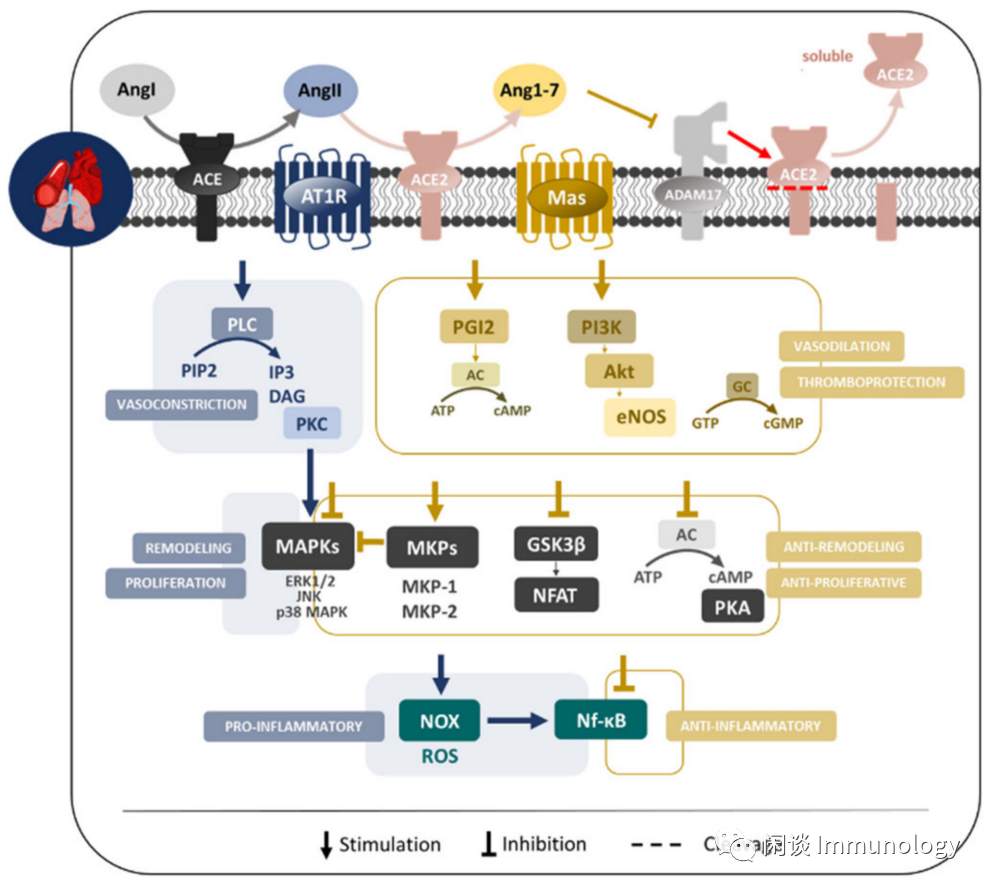
Int. J. Mol. Sci. 2021, 22, 12800
肺表达肾素-血管紧张素系统的所有主要成分,包括肺血管内皮细胞和平滑肌细胞、I型和II型肺泡上皮细胞、支气管上皮细胞或支气管平滑肌。
过度激活经典ACE/AngII/AT1R ,产生肺血管和肺实质有害反应,如血管收缩、促炎、促凋亡或促纤维化效应以及加速血栓形成,诱导氧化应激或促进生长行为,参与肺重构。
ACE2/Ang(1-7)通路通过衰减MAPKs-NF-kB通路活性,参与抗凋亡、抗炎和抗增殖反应。
简评:了解抗感染免疫的性别差异,有助于疫苗接种,临床抗感染,抗炎症治疗时,考虑性别差异化方案。
参考资料
- https://globalhealth5050.org/the-sex-gender-and-covid-19-project/
- Rehman S, Ravinayagam V, Nahvi I, Aldossary H, Al-Shammari M, Amiri MSA, Kishore U and Al-Suhaimi EA (2021) Immunity, Sex Hormones, and Environmental Factors as Determinants of COVID-19 Disparity in Women. Front. Immunol. 12:680845.
- Taneja V. Sex Hormones Determine Immune Response. Front Immunol (2018) 9:1931. doi: 10.3389/fimmu.2018.01931
- Rajtik, T.; Galis, P.; Bartosova, L.; Paulis, L.; Goncalvesova, E.; Klimas, J. Alternative RAS in Various Hypoxic Conditions: From Myocardial Infarction to COVID-19. Int. J. Mol. Sci. 2021, 22, 12800





